
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10 NA
C.在反应KIO3 + 6 HI = KI + 3 I2 + 3 H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol·L-1 的NH4NO3溶液中氮原子数为0.2 NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14 mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
下列盐的水溶液,其pH值小于7的是 ( )
A.NaHCO3溶液 B.NaCl溶液 C.Na2SO4溶液 D.NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
用H2O2溶液处理含NaCN的废水的反应原理为:NaCN + H2O2 + H2O = NaHCO3 + NH3,已知:HCN的酸性比H2CO3弱。下列有关说法正确的是( )
A.该反应中氮元素被氧化
B.该反应中H2O2作还原剂
C.0.1 mol·L-1 NaCN溶液中含有HCN和CN-的总数为0.1×6.02×1023
D.实验室配制NaCN溶液时,需加入适量的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是( )
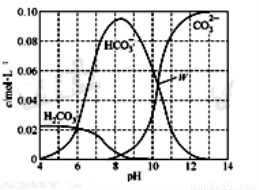
A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)<0.1mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
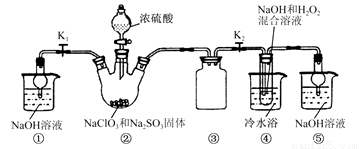
(1) 装置②中产生ClO2气体的化学方程式为 ;
装置④中制备NaClO2的化学方程式为 。
(2) 装置③的作用是 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验II. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2?+4I?+4H+==2H2O+2I2+Cl?);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L?1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32?=2I?+S4O62?)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
某羧酸酯的分子式为C57H104O6,1 mol该酯完全水解可得到3 mol羧酸M和1 mol甘油[HOCH2CH(OH)CH2OH]。羧酸M的分子式为( )
A.C17H32O2 B.C18H34O2 C.C18H36O2 D.C19H36O2
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
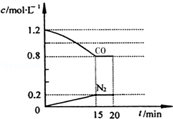 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+5O2═4NO+6H2O | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2NaHCO3═Na2CO3+H2O+CO2 | D. | Cl2+2NaBr═2NaCl+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com