
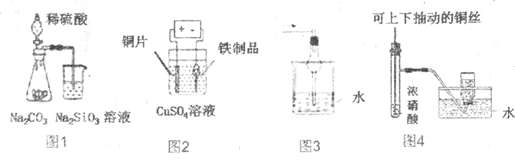
| A. | 图1为证明非金属性强弱:S>C>Si | |
| B. | 图2为在铁制品表面镀铜 | |
| C. | 图3可用于吸收氯化氢、溴化氢等气体 | |
| D. | 图4为制备并收集少量NO2气体 |
分析 A.比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较;
B.铁制品表面镀铜,Cu作阳极,铁制品作阴极,电解质溶液中含铜离子;
C.大肚瓶能防止倒吸;
D.不能用排水法收集NO2气体.
解答 解:A.比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,可证明非金属性的强弱,故A正确;
B.铁制品表面镀铜,Cu作阳极,铁制品作阴极,电解质溶液中含铜离子,图中装置符合,故B正确;
C.大肚瓶能防止倒吸,可用于吸收氯化氢、溴化氢等气体,故C正确;
D.二氧化氮与水反应,且易溶于水,不能用排水法收集NO2气体,只能用排空气法收集,故D错误.
故选D.
点评 本题考查较为综合,涉及非金属性的比较、电镀以及气体的收集,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型,难度不大,注意把握物质的性质的异同和实验操作方法.


科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,F中的含氧官能团名称酚羟基、羧基;
,F中的含氧官能团名称酚羟基、羧基; ;
; +O2$\stackrel{Cu}{→}$2
+O2$\stackrel{Cu}{→}$2 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否含有氧元素,将物质分为氧化剂和还原剂 | |
| B. | 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液是否能够导电,将物质分为电解质和非电解质 | |
| D. | 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25mL | B. | 250mL | C. | 50mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com