
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | Na2CO3、NaOH、BaCl2、HCl | ||
| C. | BaCl2、Na2CO3、NaOH、HCl | D. | BaCl2、NaOH、Na2CO3、HCl |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-) | |
| C. | Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) | |
| D. | (NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的质量之比为4:3,完全反应需要的时间之比为2:3.
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的质量之比为4:3,完全反应需要的时间之比为2:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料降解技术与化学科学无关 | |
| B. | 新能源--可燃冰的利用与化学关系密切 | |
| C. | 在垃圾处理、污水治理等方面化学科学将大有作为 | |
| D. | 随着化学科学的发展,合成橡胶的品种将越来越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH试纸用蒸馏水润湿后,测定稀盐酸的pH值 | |
| B. | 给试管里的液体加热时,试管应与桌面垂直 | |
| C. | 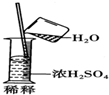 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%~5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然蛋白质中仅含C、H、O、N四种元素 | |
| B. | 重金属盐能使蛋白质变性,所以误食重金属盐会中毒 | |
| C. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 | |
| D. | 鸡蛋清加入食盐,会使蛋白质变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com