
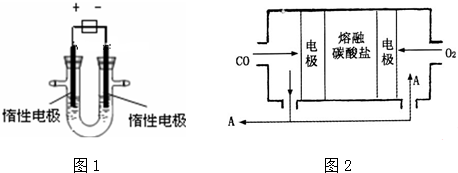
分析 (1)用惰性电极电解硫酸铜溶液时,CuSO4溶液存在的阴离子为:SO42-、OH-,OH-离子的放电能力大于SO42- 离子的放电能力,所以OH-离子放电生成氧气;
溶液中存在的阳离子是Cu2+、H+,Cu2+离子的放电能力大于H+离子的放电能力,所以Cu2+离子放电生成Cu;
(2)根据析出铜的质量计算转移电子数,根据两极转移电子数相等计算产生氧气的体积;
(3)根据析出的物质向溶液中加入它们形成的化合物即可;
(4)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;将两个方程式相加即得一氧化碳燃烧方程式;根据电极反应分析即可.
解答 解:(1)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,电极反应式为:4OH-=O2↑+2H2O+4e-;阴极上铜离子放电,电极反应式为:2Cu2++4e-=2Cu,
故答案为:4OH-=O2↑+2H2O+4e-;2Cu2++4e-=2Cu;
(2)阴极增重3.2g,应为铜的质量,n=$\frac{3.2g}{64g/mol}$=0.05 mol,
转移的电子为0.05mol×2=0.1mol,根据两电极转移的电子数目相等,则阳极转移的电子也为0.1mol,在阳极上生成氧气的物质的量为$\frac{0.1mol}{4}$=0.025mol,放出气体在标准状况下的体积为0.025mol×22.4L/mol=0.56L;
故答案为:0.56L;
(3)从溶液中析出的物质是氧气和铜,因为稀硫酸和氧气和铜都不反应,但和氧化铜反应,氧气和铜反应生成氧化铜,所以向溶液中加入氧化铜即可,
故答案为:C;
(4)该燃料电池的总反应为:2CO+O2=2CO2,通入氧气和CO2的混合气体一极为原电池的正极,发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,通入CO的一极为原电池的负极,发生氧化反应,电极反应式为:2CO-4e-+2CO32-=4CO2,由电极反应可知电池工作时参加循环的物质为CO2,
故答案为:2CO-4e-+2CO32-=4CO2;CO2.
点评 本题考查了电解原理,能正确判断溶液中离子的放电顺序从而确定析出的物质是解本题的关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 研发煤炭的洁净、高效利用技术,保护生态环境 | |
| B. | 推广CO2的再利用技术,将其合成有价值的化学品 | |
| C. | 利用工业废水灌溉农作物,提高水资源的利用率 | |
| D. | 提高风能、水能、太阳能等可再生清洁能源的使用比例 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N60与N2都是氮的同素异形体 | |
| B. | N60转化为N2属化学变化 | |
| C. | N60的总能量高于N2的总能量 | |
| D. | N60变为 N2的反应是放热反应,说明N60比N2更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
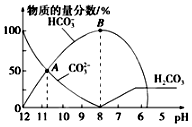 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
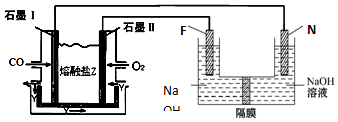
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
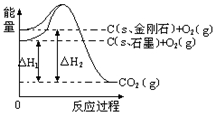
| A. | 石墨和金刚石互为同位素 | |
| B. | 金刚石的总能量比石墨的总能量高1.9 kJ | |
| C. | C(石墨)═C(金刚石)△H=+1.9 kJ•mol-1 | |
| D. | C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com