
下列说法正确的是( )
A.6.02×1023个12C原子数就是阿伏加德罗常数
B.1 mol氧的质量是32 g
C.氢原子的摩尔质量是1.008 g
D.4.9 g H2SO4是0.05 mol H2SO4
科目:高中化学 来源: 题型:
铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:

该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是________________________________________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:
___________________________________________________________________________。
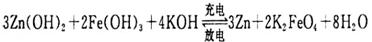 (3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:
放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是 。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
 D.容器内的密度保持不变
D.容器内的密度保持不变
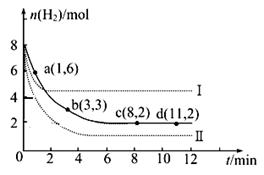
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
①a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
血液中有一种含铜的呈蓝色的蛋白质分子,其相对分子质量为151 000,已知该分子中铜的质量分数为
0.34%,则平均每个该蛋白质分子中的铜原子数为( )
A.8 B.6
C.4 D.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com