
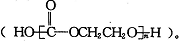 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:选择题
下列有关说法,不正确的是
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
A.仅①③④⑤ B.仅②③④
C.仅①③④ D.仅①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )
第二、三周期元素X、Y、Z、W与第四周期元素砷(33As)在周期表中的位置关系如图所示,则下列说法中正确的是( )| A、Z的氧化物可与Y的氢化物水溶液发生化学反应 |
| B、X的原子半径比As原子半径小,两者原子序数之差为29 |
| C、W的氧化物对应的水化物是共价化合物,并且必是强酸 |
| D、图中五种元素均是非金属元素,并且Y的非金属性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Bacl2 |
| ① |
| NaOH |
| ② |
| Na2CO3 |
| ③ |
| HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑化剂DEHP是指邻苯二甲酸二(2─乙基己)酯,对人体无害,可用作食品添加剂 |
| B、二氧化氮经过加压凝成无色液体为物理变化 |
| C、Na2O?SiO2是一种简单的硅酸盐,可溶于水 |
| D、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1.0 | 17.8 | 20.0 | 22.4 | ||||
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) | ||||
| B、正常体温下人体发生碱中毒时,c(H+)?c(OH-)变大 | ||||
| C、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 | ||||
D、
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com