
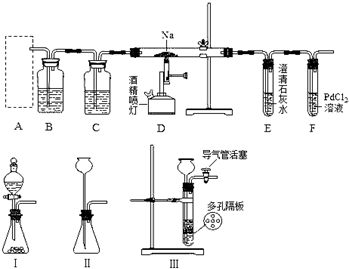
分析 (1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置,制得的二氧化碳中含有氯化氢和水蒸气,利用装置B除氯化氢,利用装置C除水蒸气;
(2)为避免空气的影响,实验前先通二氧化碳充满装置后,再点燃酒精喷灯;
(3)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,其中一种固体为碳酸钠,另一种固体为C;
②装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO;
(4)根据反应物的成分和质量守恒解答.
解答 解:(1)实验室常用碳酸钙与稀盐酸反应制取二氧化碳,反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑;制取气体的装置能“随开随用,随关随停”,是利用的启普发生器原理分析选择装置;制得的二氧化碳中含有氯化氢和水蒸气,利用装置B饱和NaHCO3除氯化氢,利用装置C浓H2SO4除水蒸气;
故答案为:Ⅲ;饱和NaHCO3;浓H2SO4;
(2)为了避免空气中氧气、水蒸气影响探究二氧化碳和钠反应的产物分析,需要先把装置中空气排出,所以打开Ⅲ的导气管活塞,先通一会CO2气体,使装置充满二氧化碳气体后再点燃酒精喷灯;
故答案为:打开Ⅲ的导气管活塞,先通一会CO2气体;E;浑浊;排出该装置中的空气,避免空气中氧气、水蒸气影响探究二氧化碳和钠反应;
(3)①装置F中无明显现象,证明没有CO生成,装置D中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,
其中一种固体为碳酸钠,另一种固体为C,反应的方程式为4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
故答案为:4Na+3CO2$\frac{\underline{\;高温\;}}{\;}$2Na2CO3+C;
②由题意可知,装置D中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,说明生成碳酸钠,
装置F中有黑色沉淀,说明PdCl2溶液能被CO还原得到黑色的Pd,所以反应产物为碳酸钠和CO,反应的化学方程式为2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO;
故答案为:2Na+2CO2$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CO;
(4)根据质量守恒定律可知,反应物CO2和Na中共有三种元素,没有氢元素,因此不能生成酸式盐,只能生成正盐;
故答案为:生成正盐;因为根据质量守恒定律可知,反应物共有三种元素,没有氢元素,因此不能生成酸式盐.
点评 本题考查了实验装置的选择,物质性质的实验设计验证分析应用,主要是钠及其化合物性质的判断理解,掌握基础是关键,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化物 | B. | 有机物 | C. | 金属或合金 | D. | 酸、碱、盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )
某同学做“证明鸡蛋壳的主要成分是碳酸盐”的实验时,设计了如图所示的方案.经检验装置气密性合格并加入试剂.下列说法中不正确的是( )| A. | Ⅰ中发生的现象为鸡蛋壳逐渐溶解,产生大量气泡 | |
| B. | Ⅱ中的澄清石灰水变浑浊 | |
| C. | Ⅲ中紫色石蕊试液变红 | |
| D. | 鸡蛋壳发生了分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
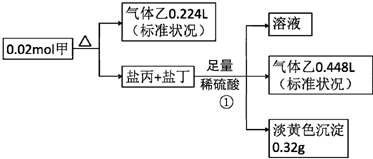
 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.
CH3COOCH2CH3+H2O,该反应类型为酯化反应或取代反应.| 实验编号 | 试管甲中试剂 | 试管乙中 试剂 | 有机层的 厚度/cm |
| A | 2mL乙醇、1mL乙酸、 1mL18mol•L-1 浓硫酸 | 饱和Na2CO3 溶液 | 3.0 |
| B | 2mL乙醇、1mL乙酸 | 0.1 | |
| C | 2mL乙醇、1mL乙酸、 3mL 2mol•L-1 H2SO4 | 0.6 | |
| D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的氯化铜溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿的空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
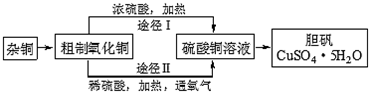
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2═CH2+HCl$\stackrel{一定条件}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$\stackrel{△}{→}$2CH3CHO+2H2O | D. |  +Br$\stackrel{FeBr_{3}}{→}$ +Br$\stackrel{FeBr_{3}}{→}$ +HBr +HBr |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com