
2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者。人类借助于这种显微镜可以观察到单个的蛋白质分子。下列有关叙述不正确是

A.蛋白质中含有碳、氢、氧、氮等元素
B.蛋白质属于高分子化合物
C.蛋白质可完全水解生成氨基酸
D.消毒过程中细菌蛋白质发生了盐析
科目:高中化学 来源:2015-2016学年甘肃省高二上学期第一次段中考试化学试卷(解析版) 题型:选择题
热激活电池可用作火箭、导弹的工作电。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池的总反应方程式为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法正确的是
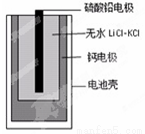
A. 正极反应式:Ca +2Cl--2e-=CaCl2
B. 放电过程中,Li+向负极移动
C. 每转移0.1mol电子,理论上生成20.7gPb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是
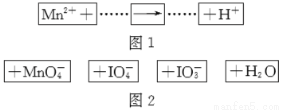
A.IO4-作氧化剂
B.若有1 mol Mn2+参加反应转移5 mol电子
C.氧化剂与还原剂的物质的量之比为5∶2
D.配平后Mn2+、H+的化学计量数分别为2、3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省黄石市高二上学期10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.任何放热反应在常温条件下一定能发生反应
C.反应物和生成物所具有的总能量决定了放热还是吸热
D.吸热反应在任何条件下都不能发生反应
查看答案和解析>>
科目:高中化学 来源:2016届江苏省无锡市高三上学期10月月考化学试卷(解析版) 题型:填空题
(15分)实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
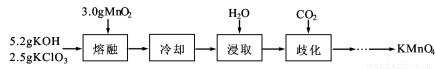
(1)熔融时需用铁坩埚和铁制搅拌棒而不能用玻璃仪器,其原因是 。
(2)熔融时,MnO2转化为K2MnO4,KClO3转化为KCl,其反应的化学方程式为 。
(3)几种物质的溶解度曲线如图所示。

①歧化时,通入CO2至pH为10~11,K2MnO4绿色溶液转化为KMnO4和MnO2。其反应的离子方程式为 。
②歧化时不能通入过量CO2的原因是 。
③通入CO2后,用玻璃棒蘸取溶液点于滤纸上,观察到 ,证明歧化反应已发生。
④歧化后得到KMnO4晶体的操作依次为过滤、 、 及干燥。
(4)在此实验流程中可循环使用的物质的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.煤的主要组成为苯以及苯的同系物
B.“可燃冰”为水可能变成油提供了有力的证据
C.油脂、淀粉、纤维素、蛋白质都是高分子化合物
D.石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二上学期第一次月考化学试卷(解析版) 题型:选择题
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是

A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省枣阳市高三上学期第一次月考化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)A、B、C、D、E为原子序数依次增大的五种元素,A的价电子层中的未成对电子有3个,B的最外层电子数为其内层电子数的3倍,C、D为同周期元素,C元素基态原子的3p轨道上有4个电子,D元素最外层有一个未成对电子,E位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。回答下列问题:
(1)D原子的核外电子排布式为 ,E的价层电子排布图为_________________。
(2)单质B有两种同素异形体,其中沸点高的是 (填分子式),原因是 ;
(3)A、B、C中第一电离能最大的是________(填元素符号),其中A的氢化物(AH3)分子中,A原子轨道的杂化类型是 。
(4)化合物D2B的立体构型为 ,单质D与湿润 的Na2CO3反应可制备D2B,其化学方程式为 .
的Na2CO3反应可制备D2B,其化学方程式为 .
(5)E与C所形成化合物晶体的晶胞如右图所示。

①在1个晶胞中,E离子的数目为 。
。
②该化合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:实验题
(9分)实验室欲配制0.05mol·L-1的NaOH溶液500mL,有以下仪器:
①烧杯② 100mL量筒 ③100mL容量瓶④胶头滴管⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有_______________(填代号),还缺少的仪器是_______________。该实验中两次用到玻璃棒,其作用分别是_______________________,____________________。
(2)使用容量瓶前必须进行的的一步操作是____________________________________。
(3)配制溶液时,一般可以分为以下几个步骤:
①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却
其正确的操作顺序为_______________________(用序号填写)在①操作中需称量NaOH__________g
(4)若定容时,眼睛仰视刻度线,所得溶液的浓度 (偏高、不变、偏低)。
(5)若某学生用托盘天平称量药品时,在托盘天平左盘放有20g砝码,天平达平衡时游码的位置如图,则该同学所称量药品的质量为_____________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com