
| A. | 将待测液NaOH溶液取到锥形瓶后,露置空气中较长时间,以酚酞为指示剂测定 | |
| B. | 以甲基橙为指示剂,当甲基橙变红时停止滴定 | |
| C. | 移液管用蒸馏水冲洗后直接移取待测液 | |
| D. | 滴定终点读数时俯视 |
分析 根据c(待测)=$\frac{V(标准)×c(标准)}{V(待测)}$分析不当操作对V(标准)的影响来此判断浓度的误差,导致测定的NaOH浓度值偏大,则硫酸的体积偏大,以此解答该题.
解答 解:A.将待测液NaOH溶液取到锥形瓶后,露置空气中较长时间,氢氧化钠变质生成碳酸钠,以酚酞为指示剂测定,终点时生成碳酸氢钠,消耗的硫酸偏少,则误差偏小,故A错误;
B.以甲基橙为指示剂,当甲基橙变红时停止滴定,超过了滴定终点,所用硫酸偏多,则误差偏大,滴定终点颜色变为黄色变为橙色,故B正确;
C.移液管用蒸馏水冲洗后直接移取待测液,导致氢氧化钠浓度偏低,消耗硫酸偏少,误差偏小,故C错误;
D.滴定终点读数时俯视,硫酸体积偏小,误差偏小,故D错误.
故选B.
点评 本题考查酸碱中和滴定实验,为高频考点,侧重于学生的分析能力和实验能力的考查,题目难度不大,注意把握实验的误差分析,把握实验基本操作.


科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |
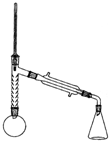
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
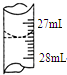 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
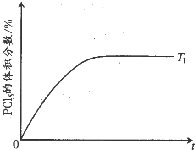
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解NaH2PO2溶液,其阴极反应式为:2H2O-4e-═O2↑+4H+ | |
| B. | H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-═PO23-+3H2O | |
| C. | 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4 | |
| D. | H3PO2溶于水的电离方程式为H3PO2?H++H2PO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com