
分析 (1)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})V(酸)}{V(酸)+V(碱)}$,据此计算酸碱体积之比;
(2)若1体积硫酸恰好与10体积pH=11的NaOH的溶液完全反应,说明酸的物质的量是碱的一半,pH=11的c(NaOH)=0.001mol/L,2n(H2SO4)=n(NaOH);
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,V1L盐酸溶液与V2LNaOH溶液中和后溶液pH=7,说明二者恰好完全反应生成NaCl,则n(HCl)=n(NaOH),c(HCl)=10-amol/L,c(NaOH)=10b-14mol/L,$\frac{{V}_{1}}{{V}_{2}}$=10a+b-14,据此分析解答.
解答 解:(1)pH=13的强碱溶液中c(OH-)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,混合液的pH=11,则混合溶液中c(OH-)=10-3mol/L=$\frac{c(O{H}^{-})V(碱)-c({H}^{+})V(酸)}{V(酸)+V(碱)}$=$\frac{0.1×V(碱)-0.01×V(酸)}{V(酸)+V(碱)}$,则强碱和强酸的体积1:9,
故答案为:1:9;
(2)若1体积硫酸恰好与10体积pH=11的NaOH的溶液完全反应,说明酸的物质的量是碱的一半,pH=11的c(NaOH)=0.001mol/L,2n(H2SO4)=n(NaOH),设硫酸的浓度为xmol/L,硫酸的体积为1L、氢氧化钠的体积为10L,
则2×x=0.001×10,x=0.005,则硫酸和氢氧化钠的物质的量浓度之比=0.005mol/L:0.001mol/L=5:1,
故答案为:5:1;
(3)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,V1L盐酸溶液与V2LNaOH溶液中和后溶液pH=7,说明二者恰好完全反应生成NaCl,则n(HCl)=n(NaOH),
如果a+b=14,则c(HCl)=10-amol/L,c(NaOH)=10b-14mol/L,10-amol/L×V1L=10b-14mol/L×V2L,则$\frac{{V}_{1}}{{V}_{2}}$=1:1;
如果a+b=13,则c(HCl)=10-amol/L,c(NaOH)=10b-14mol/L,10-amol/L×V1L=10b-14mol/L×V2L,则$\frac{{V}_{1}}{{V}_{2}}$=10a+b-14=1:10;
如果a+b=15,则c(HCl)=10-amol/L,c(NaOH)=10b-14mol/L,10-amol/L×V1L=10b-14mol/L×V2L,则$\frac{{V}_{1}}{{V}_{2}}$=10a+b-14=10:1;
若a+b>14,则$\frac{{V}_{1}}{{V}_{2}}$=10a+b-14>1,即Va>Vb;
故答案为:1:1;1:10;10:1;10a+b-14;>.
点评 本题考查酸碱混合溶液定性判断及pH值的有关计算,为高频考点,侧重考查学生分析计算能力,明确反应前酸碱的物质的量关系是解本题关键,难点是(3)题有关计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
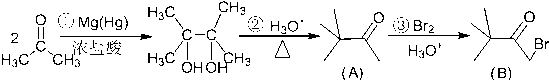
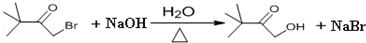 .
. ,则该同分异构体的结构简式为:
,则该同分异构体的结构简式为: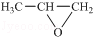 .
.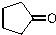 )来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为:
)来代替丙酮,连续发生上述路线中反应①、②之后,得到的有机产物的结构简式为: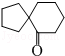 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若铁粉有剩余,则不溶物中一定有铜 | |
| B. | 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+ | |
| C. | 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+ | |
| D. | 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| d | e | f | |||||||||||||||
| c | g | h | |||||||||||||||
| A | B | C | D | ||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl(aq),HCl(aq) | B. | HNO3(aq),KNO3(aq) | C. | HCl(aq),BaCl2(aq) | D. | NaNO3(aq),HNO3(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏、煤的干馏均是物理变化 | |
| B. | 铅蓄电池、锂电池、碱性锌锰干电池都属于二次电池 | |
| C. | 资源的“3R”即减少消耗(Reduce)、增加重复使用(Reuse)、重复再生(Recycle)有利于实现“低碳生活” | |
| D. | PM2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3+6HCl═3Cl2↑+KCl+3H2O反应中还原剂与氧化剂的物质的量之比为6:1 | |
| B. | 硝酸铵受热分解的化学方程式为:5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O,在反应中被氧化与被还原的氮原子数之比为5:3 | |
| C. | 工业上制备新型净水剂高铁酸钾(K2FeO4)的一步反应如下:2FeCl3+10NaOH+3NaClO═2Na2FeO4+9NaCl+5H2O,若有2 mol FeCl3发生反应,转移电子的物质的量为6 mol | |
| D. | 氮化铝广泛应用于电子陶瓷等工业领域.在一定条件下,AlN可通过反应:Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成,方程式中AlN中氮的化合价为-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同系物之间在化学性质上相似 | |
| B. | 同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化 | |
| C. | 同系物不可能是同分异构体 | |
| D. | 分子组成相差一个或几个CH2原子团的物质互称为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com