
【题目】(1)同温同压下,同体积的SO2与SO3质量之比为________,氧原子个数之比为________。
(2)在标准状况下,14g某气体的体积为11.2L,则该气体的相对分子质量是______________。
(3)在溶液中0.2 mol MnO4- 恰好能使0.5 mol SO32-离子完全氧化为SO42-,则Mn元素被还原后的化合价是________(填选项)。
A. +2 B. +3 C. +4 D. +5
【答案】4:5 2:3 28 A
【解析】
(1)根据PV=nRT及分子结构进行计算;
(2)利用公式M=![]() 及相对分子质量数值上等于摩尔质量,求解;
及相对分子质量数值上等于摩尔质量,求解;
(3)根据氧化还原反应中,化合价升降的总数相等,计算。
(1)同温同压下,同体积的SO2与SO3的物质的量相同,则物质的质量之比等于摩尔质量之比,即64:80=4:5;SO2与SO3中的O原子个数分别为分子个数的2、3倍,则氧原子个数之比为2:3;
(2)在标准状况下,11.2L的某气体的物质的量为0.5mol,M=![]() =
=![]() g/mol=28g/mol,相对分子质量数值上等于摩尔质量,分子量为28;
g/mol=28g/mol,相对分子质量数值上等于摩尔质量,分子量为28;
(3)根据氧化还原反应中,化合价升降的总数相等,即S化合价由+4变为+6,升高总数为2×0.5=1,Mn化合价降低总数=(+7-a)×0.2=1,则a=+2,答案为A。


科目:高中化学 来源: 题型:
【题目】我国化学侯德榜改革国外的纯碱生产工艺,生产流程如图所示,下列说法不正确的是( )

A. 在沉淀池中应先通入氨气,再通入二氧化碳气体
B. 该反应原理: NH3+CO2+H2O=HCO3-+NH4+
C. 循环1中X是二氧化碳
D. 在过滤后的母液中加入氯化钠粉末、通入氨气,搅拌,经冷却结晶后可得氯化铵晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是__,其中氧化性最强的是___。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑__;
②2HCl![]() H2↑+Cl2↑__。
H2↑+Cl2↑__。
(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:
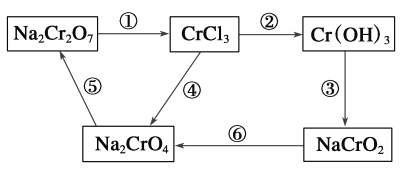
①在上述有编号的步骤中,需用还原剂的是__,需用氧化剂的是___。(填编号)
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+___。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。
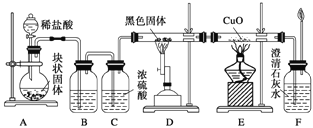
(1)写出装置A中发生反应的化学反应方程式:_______________________。
(2)装置B中最适宜的试剂是:_________________________。
(3)装置D中黑色固体为_____________(填名称),反应的化学方程式为:_____________________________。
(4)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是: ___________________________________。
(5)按照如图装置进行实验时,首先进行的操作名称是_____________。
(6)根据实验中的_________________现象,可证明CO具有还原性,有关反应的化学方程式是___________________________。
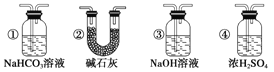
(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的___________装置(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质转化在给定条件下能实现的是
A.FeS2![]() SO3
SO3![]() H2SO4
H2SO4
B.NaCl(aq)![]() Na
Na![]() Na2O2
Na2O2
C.Fe![]() FeSO4(aq)
FeSO4(aq)![]() Fe(OH)2
Fe(OH)2![]() Fe2O3
Fe2O3
D.Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() Fe
Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。下图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
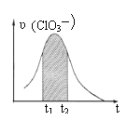
A. 反应开始时速率增大可能是c(H+)所致
B. 纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C. 后期速率υ下降的主要原因是反应向逆反应方向进行
D. 图中阴影“面积”可以表示t1-t2时间内c(SO42-)增加量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式:_____________________________
(2)干燥管C内盛放的药品可以是______或________(填化学式)。干燥管的________(填“m”或“n”)端与g导管相连接。
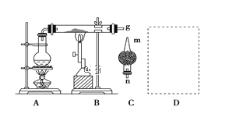
(3)在g处用试管收集氢气,简述用简单的方法检验收集到的气体是氢气的实验操作步骤和现象:_______________________________________
(4)停止反应后,待B处硬质玻璃管冷却后,取其中固体溶于过量的稀盐酸充分反应得溶液a,
①欲检验溶液中含有Fe3+,选用的试剂为溶液,现象是______________。
②该实验小组用上述试剂没有检测到Fe3+, 另取溶液a,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色,溶液中反应的离子方程式为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的
pQ (g)+2mZ(g),达到平衡时c( X) =0.3 mol L-1。其他条件不变,将容器体积缩小到原来的![]() ,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
,重新平衡后c(X) =0.5 mol L-1。下列说法正确的是
A.平衡逆方向移动B.Y 可能是固体
C.系数n>mD.Z 的体积分数减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com