
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。
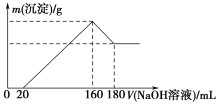
(1)加入NaOH溶液0~20 mL时的反应的离子方程式为________________,160~180 mL时的反应的离子方程式为____________________________。
(2)合金中Mg的质量为________g,所用HCl的物质的量浓度为________mol/L。
【答案】H++OH-===H2O Al(OH)3+OH-===AlO![]() +H2O )4.8 8
+H2O )4.8 8
【解析】
(1)由题图可知,加入NaOH溶液的体积小于20 mL时,没有沉淀生成,说明原溶液中溶解Mg、Al后,盐酸有剩余,则发生的反应为HCl+NaOH=NaCl+H2O;继续滴加NaOH溶液至160 mL时,沉淀量最大,沉淀为Mg(OH)2和Al(OH)3,溶液为NaCl溶液;再继续滴加NaOH溶液,发生反应:Al(OH)3+NaOH=NaAlO2+2H2O。
(2)由题图可知,产生沉淀的过程中消耗氢氧化钠溶液140 mL,由OH-守恒可知3n[Al(OH)3]+2n[Mg(OH)2]=n(NaOH)=(0.16 L-0.02 L)×5 mol/L=0.7 mol;溶解Al(OH)3的过程中发生反应Al(OH)3+NaOH=NaAlO2+2H2O,消耗氢氧化钠溶液20 mL,所以n[Al(OH)3]=(0.18 L-0.16 L)×5mol/L=0.1 mol,故n[Mg(OH)2]=0.2 mol,由原子守恒可知n(Mg)=n[Mg(OH)2]=0.2 mol,所以Mg的质量为0.2 mol×24 g/mol=4.8 g。加入氢氧化钠溶液为160 mL时,沉淀量最大,溶液为氯化钠溶液,根据钠原子守恒,溶液中n(NaCl)=n(NaOH)=0.16 L×5 mol/L=0.8 mol,根据氯原子守恒n(HCl)=n(NaCl)=0.8 mol,故HCl的物质的量浓度为![]() =8 mol/L。
=8 mol/L。


科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系:
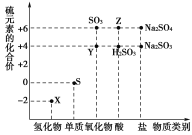
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为________。
(3)检验物质Y的方法是_________________________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为______________________________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是( )

A. X、Y、Z三种元素最低价氢化物的沸点依次升高
B. 由X、Y和氢三种元素形成的化合物中只有共价键
C. 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性
D. T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有__。
(Ⅱ)(3)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象:_______,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为__________________.
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com