
| A. | HCl、H2SO4、S | B. | 金刚石、Na3PO4、Mg | ||
| C. | HF、SiC、Ar | D. | H2O、SiO2、K2CO3 |
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
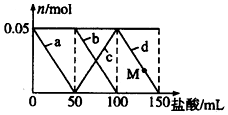 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
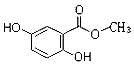
 .
.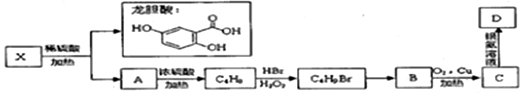
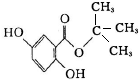 ,C4H9Br→B的化学反应是取代反应.
,C4H9Br→B的化学反应是取代反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
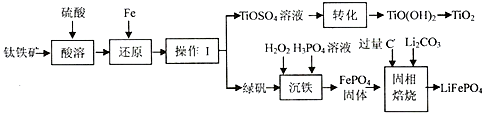
| 温度(℃) | 30 | 20 | l5 | l0 | 5 | 0 | -2 | -6 |
| FeSO4(g/L) | 240 | 190 | 130 | 117 | 95 | 79 | 59 | 38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将乙烯和乙炔气体分别通入溴的四氯化碳溶液中,两者都褪色 | |
| B. | 甲烷和氯气在室温下的光照环境中可以稳定存在 | |
| C. | 苯能使溴水褪色是因为二者反应生成了溴苯 | |
| D. | 要除去乙烷中的乙烯制得纯净的乙烷,将混合气体通入酸性高锰酸钾溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
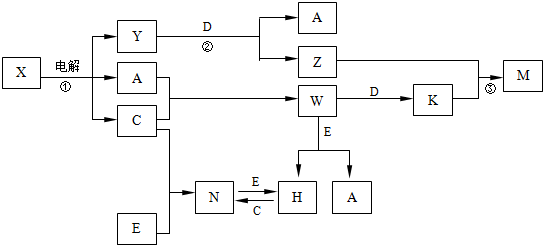
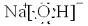 ,构成C单质的元素在周期表中位于第三周期第VIIA族
,构成C单质的元素在周期表中位于第三周期第VIIA族查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com