
分析 向一个体积可变的密闭容器中充入3mol A、1mol B,在T°C时达到平衡,测得混合气体中D的物质的量为2.0mol,则:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):3 0
变化量(mol):2 2
平衡量(mol):1 2
(1)根据v=$\frac{△c(D)}{△t}$计算v(D),A的转化率=$\frac{反应的A的物质的量}{A的起始物质的量}$×100%,反应前后气体的物质的量不变,用物质的量代替浓度代入K=$\frac{{c}^{3}(D)}{{c}^{3}(A)}$计算平衡常数;
(2)增大压强反应速率增大,反应前后气体的化学计量数不变,平衡不移动;
(3)反应气体混合气体总的物质的量不变,温度升高时混合气体的平均相对分子质量减小,说明升高温度,混合气体的总质量减小,由于相对分子质量M(B)<2M(C),故升高温度平衡向正反应方向移动;
(4)设转化时D为xmol,表示出平衡时A、D的物质的量,根据平衡常数列方程,再计算平衡时D的物质的量,再根据V=$\frac{n}{c}$计算体积.
解答 解:向一个体积可变的密闭容器中充入3mol A、1mol B,在T°C时达到平衡,测得混合气体中D的物质的量为2.0mol,则:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):3 0
变化量(mol):2 2
平衡量(mol):1 2
(1)v(D)=$\frac{\frac{2mol}{10L}}{2min}$=0.1mol/(L.min),A的转化率=$\frac{2mol}{3mol}$×100%=66.7%,反应前后气体的物质的量不变,用物质的量代替浓度计算平衡常数,则K=$\frac{{c}^{3}(D)}{{c}^{3}(A)}$=$\frac{{2}^{3}}{{1}^{3}}$=8,
故答案为:0.1mol/(L.min);66.7%;8;
(2)增大压强正、逆反应速率都增大,反应前后气体的化学计量数不变,平衡不移动,容器中D的体积分数不变,
故答案为:增大;不变;
(3)反应气体混合气体总的物质的量不变,温度升高时混合气体的平均相对分子质量减小,说明升高温度,混合气体的总质量减小,由于相对分子质量M(B)<2M(C),故升高温度平衡向正反应方向移动,则正反应为吸热反应,
故答案为:吸热;
(4)设转化时D为xmol,则:
3A(g)+B(s)?2C(s)+3D(g)
起始量(mol):0 6
变化量(mol):x x
平衡量(mol):x 6-x
则$\frac{(6-x)^{3}}{{x}^{3}}$=8,解得x=2,故平衡时D为(6-2)mol=4mol,故平衡时D浓度为1mol/L,则容器的体积=$\frac{4mol}{1mol/L}$=4L,
故答案为:4.
点评 本题考查化学平衡计算与影响因素、反应速率计算等,(4)中由于反应前后气体的物质的量不变,压强不影响平衡移动,可以利用等效平衡解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 普通玻璃和钢化玻璃的成分不一样,钢化玻璃中加了玻璃钢 | |
| B. | 水泥的主要成分是硅酸二钙、硅酸三钙和铝酸三钙 | |
| C. | 水泥具有水硬性,因此在保存和运输过程中要注意防水防潮 | |
| D. | 陶瓷的釉料在烧制时,若空气过量,一般显示的是高价态的金属的颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:
用3.2g含有一定杂质的镁条与足量的稀硫酸反应制取氢气(杂质不与硫酸反应),收集到氢气2.24L(已折算到标准状况下),再往反应后的溶液中滴加NaOH溶液,使镁元素转化成Mg(OH)2沉淀,发现生成的沉淀质量与加入NaOH溶液中NaOH的物质的量有如图所示关系,试求:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.
如图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时V(A)=V(B)=a L.在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g)?2Z(g)+W(g);△H>0,达到平衡时,V(A)=1.1a L.| A. | 反应开始时,B容器中化学反应速率比A容器中快 | |
| B. | A容器中X的转化率为20%,且比B容器中X的转化率小 | |
| C. | 打开K一段时间,达新平衡时,A的体积为2.3a L(连通管中气体体积不计) | |
| D. | 打开K达新平衡时,升高B容器的温度,A容器的体积会增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
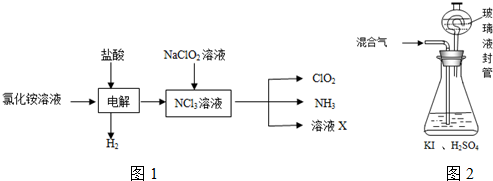
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
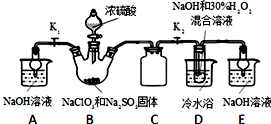
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| B. | 在分液漏斗中用酒精萃取碘水中的碘,分液时下层液体从下口放出,上层液体从上口倒出 | |
| C. | 配制浓H2SO4和浓HNO3的混酸时,应将浓H2SO4慢慢加到浓HNO3中,并及时搅拌 | |
| D. | 用蒸发结晶的方法可使NaCl从溶液中析出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com