
 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 的名称是1,3-二甲基苯
的名称是1,3-二甲基苯分析 ①烷烃命名时,要选最长的碳链为主链,从离支链近的一端给主链上碳原子编号,据此分析;
②苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小.
③3-甲基-2-戊烯的主链上有5个碳原子,在2号和3号碳原子之间有一条碳碳双键,在3号碳原子上有一个甲基,据此写出结构简式.
解答 解:①烷烃命名时,要选最长的碳链为主链,故主链上有8个碳原子,从离支链近的一端给主链上碳原子编号,故在2号和6号碳原子上各有一个甲基,故名称为:2,6-二甲基辛烷,故答案为:2,6-二甲基辛烷;
②苯的同系物在命名时,从简单的侧链开始按顺时针或逆时针给主链上的碳原子进行编号,使侧链的位次和最小,故两个甲基分别在1号和3号碳原子上,故名称为1,3-二甲基苯,故答案为:1,3-二甲基苯.
③3-甲基-2-戊烯的主链上有5个碳原子,在2号和3号碳原子之间有一条碳碳双键,在3号碳原子上有一个甲基,故3-甲基-2-戊烯的结构简式是:CH3CH=C(CH3)CH2CH3;故答案为:CH3CH=C(CH3)CH2CH3.
点评 本题考查了有机物的命名,应注意的是当有机物中含官能团时,命名时优先考虑的对象是官能团.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:解答题
 .A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
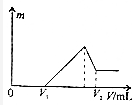 将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )
将0.1mol的镁、铝混合物溶于100mL2mol/LH2SO4溶液中,然后再滴加1mol/LNaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V2=460mL时,则原混合物中镁铝的质量比是( )| A. | 1:1 | B. | 2:3 | C. | 16:27 | D. | 8:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 解释或结论 |
| A | 过量的铁粉中加入稀硝酸中,充分反应后,滴入KSCN溶液,溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | AgI固体中滴入KCl溶液,沉淀由黄色变为白色 | AgI比AgCl难溶 |
| C | 铝箔插入稀硝酸中,无现象 | 铝箔表面被硝酸氧化,形成致密的氧化膜 |
| D | 苯酚溶液中滴加溴水,出现白色沉淀 | 苯酚易发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2gC5H12含有共价键数为1.6NA | |
| B. | 14g乙烯和丙烯的混合物中含有原子的数目为NA | |
| C. | 标准状况下,224mL己烷充分燃烧后生成的CO2的分子数为0.06NA | |
| D. | 1.7g羟基(-OH)含有的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA | |
| B. | 标准状况下,11.2 L甲醛所含的σ键数目为2NA | |
| C. | 2mol NO和1mol O2混合,在密闭容器中充分反应后,容器内的分子数等于2NA | |
| D. | 1mol Fe 与足量的硝酸反应,转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com