
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①CO2中只含极性键,属于共价化合物;
②KCl只含有离子键的离子化合物;
③氮气只含非极性键的单质;
④H2中只含非极性键,属于单质;
⑤NH4Cl中含有离子键和极性键,属于离子键化合物;
⑥NaOH中含有离子键和极性键,属于离子键化合物;
⑦氨气中只含极性键,属于共价化合物;
(1)只有非极性键的是氮气和氢气,
故答案为:③④;
(2)只有极性键的是①和⑦,
故答案为:①⑦;
(3)只有离子键的是②,
故答案为:②;
(4)既有离子键,又有极性键的是⑤⑥,
故答案为:⑤⑥;
(5)属于共价化合物的是 ①⑦,
故答案为:①⑦.
点评 本题考查了物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=0.99×10-6 mol•L-1 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液,c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | 0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:(H+)=c(OH-)+c(HCO3-)+2c(H2CO3) | |
| D. | 0.1 mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和Al2(SO4)3 | B. | Ca(OH)2溶液和NaHCO3 | ||
| C. | CaCl2和Na2CO3 | D. | Ba(OH)2和NaHSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (X+Y+n)g | B. | (X+Y-n)g | C. | (X+Y-n)/NA g | D. | (X+Y+n)/NAg |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 混合物 | 需加入的试剂 | 分离方法 |
| ①苯(苯酚) | ||
| ②乙酸乙酯(乙酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性气味.工业上,提纯粗硅的原理如下:粗硅$→_{△}^{HCl}$SiCl4$→_{△}^{Si+H_{2}}$SiHCl3$→_{△}^{H_{2}}$Si(纯)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| CaO2平均生成速率(×10-3mol.s-1) | 7.5 | 8.2 | 9.4 | 8.0 | 7.1 | 6.7 | 5.5 |
| t/min | 0 | 10 | 20 | 30 | 40 |
| φ(CO) | 0.250 | 0.235 | 0.225 | 0.200 | 0.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| B. | 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| C. | 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| D. | 用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
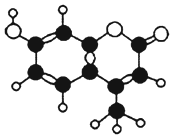 可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )
可调谐激光器所用的某种染料由C、H、O三种元素组成,分子球棍模型如图所示,下列关于该染料的叙述正确的是( )| A. | ①③⑤ | B. | ③④⑤ | C. | ③④⑤⑥ | D. | ②③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com