
【题目】Ⅰ、A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):试回答:
![]()
(1)若D是具有氧化性的单质,A为金属且属于主族,写出B和D生成C 的化学方程式_________________________。
(2)若D是金属,A是强酸,写出A和D生成B的化学方程式______________;且A和C可生成B,写出该离子方程式______________________________。
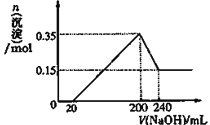
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,写出该反应的离子方程式_________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入200mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示 。则固体混合物中E的质量为______,H2SO4溶液的物质的量浓度为_______mol/L。
Ⅱ、含氮废水进入水体而对环境造成的污染越来越严重,环境专家认为可以用金属铝将水体中的NO![]() 还原为N2 ,从而消除污染。其反应的离子方程式是:6NO
还原为N2 ,从而消除污染。其反应的离子方程式是:6NO![]() +10Al+18H2O=3N2↑+10Al(OH)3+6OH-
+10Al+18H2O=3N2↑+10Al(OH)3+6OH-
(1)上述反应中,生成标准状况下5.6L氮气时,转移的电子为___________mol;
(2)有人认为金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。
①写出镁和含氮废水反应的离子方程式_________________________________;
②已知金属镁可以从海水中提取的MgCl2通过电解制得的,若要除去1m3含氮元素0.2mol的废水中的NO![]() (设氮元素都以NO
(设氮元素都以NO![]() 的形式存在),则至少需要含0.5%(质量分数)MgCl2的海水___________kg。
的形式存在),则至少需要含0.5%(质量分数)MgCl2的海水___________kg。
【答案】 2Na2O+O2![]() 2Na2O2 Fe+4HNO3=Fe(NO3)3+NO↑+2H2O 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O Al3 ++3AlO2-+6H2O=4Al(OH)3↓ 5.4g 2.5 2.5 5Mg+2NO3-+6H2O=N2↑+5Mg(OH)2+2OH- 9.5
2Na2O2 Fe+4HNO3=Fe(NO3)3+NO↑+2H2O 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O Al3 ++3AlO2-+6H2O=4Al(OH)3↓ 5.4g 2.5 2.5 5Mg+2NO3-+6H2O=N2↑+5Mg(OH)2+2OH- 9.5
【解析】Ⅰ、(1)D是具有氧化性的单质,A元素为主族金属元素,根据反应关系可知A为Na,B为Na2O,D为O2,C为Na2O2;B和D反应生成C的化学方程式为2Na2O+O2![]() 2Na2O2;(2)若D是金属,A是强酸,由转化关系可知D为变价金属,应为Fe,B是铁盐,C是亚铁盐,A和D生成B,这说明A是氧化性酸,A是硝酸,则A和D生成B的化学方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;A和C可生成B,该反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,因此含有的金属元素是Al,则B是氢氧化铝,A和C发生的是铝盐和偏铝酸盐之间的反应,该反应的离子方程式为Al3 ++3AlO2-+6H2O=4Al(OH)3↓。化合物B经过一系列反应可以得到单质E,E是金属铝。将一定质量的Mg和Al的混合物投入200mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。根据图像可知反应中稀硫酸过量,0~20mL氢氧化钠中和剩余的硫酸,20~200mL沉淀镁离子和铝离子,200~240mL溶解氢氧化铝,根据纵坐标可判断生成的氢氧化铝是0.35mol-0.15mol=0.20mol。因此根据原子守恒可知固体混合物中Al的质量为0.2mol×27g/mol=5.4g。溶解0.2mol氢氧化铝消耗0.2mol氢氧化钠,则氢氧化钠溶液的浓度是0.2mol÷0.04L=5.0mol/L。沉淀达到最大值时溶液中的溶质是硫酸钠,根据钠离子守恒可知硫酸钠的物质的量是(0.2L×5mol/L)/2=0.5mol,所以H2SO4溶液的物质的量浓度为0.5mol÷0.2L=2.5mol/L。
2Na2O2;(2)若D是金属,A是强酸,由转化关系可知D为变价金属,应为Fe,B是铁盐,C是亚铁盐,A和D生成B,这说明A是氧化性酸,A是硝酸,则A和D生成B的化学方程式为Fe+4HNO3=Fe(NO3)3+NO↑+2H2O;A和C可生成B,该反应的离子方程式为3Fe2++4H++NO3-=3Fe3++NO↑+2H2O。(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,因此含有的金属元素是Al,则B是氢氧化铝,A和C发生的是铝盐和偏铝酸盐之间的反应,该反应的离子方程式为Al3 ++3AlO2-+6H2O=4Al(OH)3↓。化合物B经过一系列反应可以得到单质E,E是金属铝。将一定质量的Mg和Al的混合物投入200mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。根据图像可知反应中稀硫酸过量,0~20mL氢氧化钠中和剩余的硫酸,20~200mL沉淀镁离子和铝离子,200~240mL溶解氢氧化铝,根据纵坐标可判断生成的氢氧化铝是0.35mol-0.15mol=0.20mol。因此根据原子守恒可知固体混合物中Al的质量为0.2mol×27g/mol=5.4g。溶解0.2mol氢氧化铝消耗0.2mol氢氧化钠,则氢氧化钠溶液的浓度是0.2mol÷0.04L=5.0mol/L。沉淀达到最大值时溶液中的溶质是硫酸钠,根据钠离子守恒可知硫酸钠的物质的量是(0.2L×5mol/L)/2=0.5mol,所以H2SO4溶液的物质的量浓度为0.5mol÷0.2L=2.5mol/L。
Ⅱ、(1)标准状况下5.6L氮气的物质的量是0.25mol,反应中氮元素化合价从+5价降低到0价,所以转移电子的物质的量是0.25mol×5×2=2.5mol;(2)①金属镁比铝能更快消除氮的污染,反应原理和金属铝相同,所以产物为氮气、氢氧化镁、氢氧根离子,离子方程式为5Mg+2NO3-+6H2O=N2↑+5Mg(OH)2+2OH-;②令至少需要含0.5%(质量分数)MgCl2的海水m kg,则根据方程式可知:
5MgCl2~~~~5Mg~~~~2NO3-
5×95g 2mol
1000m g×0.5% 0.2mol
解得![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列物质或离子在指定分散系中能大量共存的是
A.空气中:H2、HCl、NO、NH3
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO、CuO、SiO2等氧化物杂质)制取金属锌的流程如图所示。回答下列问题:

(1)ZnFe2O4中Fe的化合价为______价,已知ZnFe2O4能溶于酸,则酸浸时ZnFe2O4反应的离子方程式为_________________________,酸浸后滤渣的成分主要是__________。
(2)酸浸时一般要将锌焙砂粉碎,其目的是提高酸浸效率,为达到这一目的,还可以采用的方法是___________________(任答一条即可)
(3)净化Ⅰ中H2O2参与反应的离子方程式为_________________________________,试剂X的作用是_______________,
(4)净化Ⅱ中得到的Y是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
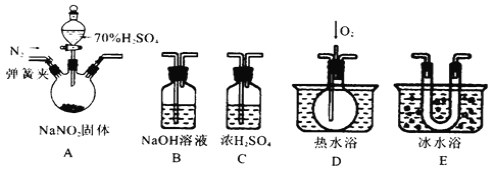
已知:① NO+NO2+2OH-=2NO2-+H2O
② 气体液化的温度:NO2(21℃)、NO(–152℃)
(1)反应前应打开弹簧夹,先通入一段时间氮气,目的是________________________。
(2)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→_____________;组装好仪器后,接下来进行的操作是________________。
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后,A中产生红棕色气体。
① 确认A中产生气体含有NO,依据的现象是_____________________________。
② 装置E的作用是_______________________________________________________。
(4)如果没有装置C,对实验结论造成的影响是______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“粗盐提纯”实验中,下列操作正确的是( )
A. 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤
B. 蒸发到析出晶体时才需要用玻璃棒搅拌
C. 当蒸发皿中出现较多量晶体时就应停止加热
D. 待溶液蒸干后即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g) 在1L的密闭容器中进行,30s后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
4NO(g)+ 6H2O(g) 在1L的密闭容器中进行,30s后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为( )
A. v(NH3)= 0.1 mol·L1·s-1 B. v(O2)= 0.01 mol·L1·s-1
C. v(NO)= 0.01 mol·L1·s-1 D. v(H2O)= 0.045 mol·L1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的离子组是
A. Mg2+、NH4+、C1-、OH- B. Na+、AlO2-、CO32-、OH-
C. Ca2+、Fe2+、H+、NO3- D. Fe3+、K+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
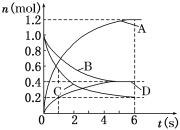
A.反应进行到6 s时,各物质的反应速率相等
B.反应进行到1 s时,v (A)=v (C)
C.反应进行到6 s时,B的平均反应速率为0.1 mol/(L·s)
D.该反应的化学方程式为3B+4 C![]() 6A+2D
6A+2D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com