
�����Ϊ2 L���ܱ������г���2 molSO2��1 mol O2�������ʼ����ѹǿΪp��һ�������·�����Ӧ��2SO2(g)��O2(g)2SO3(g)��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
A������2 mol SO3��SO2�����ʵ�������
B����һ�η�Ӧ�ﵽƽ��ʱ���ų�����176.4kJ
C������2 mol SO3�ﵽ��ƽ��ʱ�������ڵ�ѹǿΪ1.4p
D�������������¶ȿ�ʹ��ƽ��ʱ�����ʵ�����������һ��ƽ��ʱ��ͬ

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO(g) �� 2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g) �� 3H2(g) ![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��ͼ�Ƿ�ӦI��Ӧ�����е������仯���ߡ�
��1������ͼ��֪��ӦIΪ ��Ӧ��ѡ����ȡ����ȡ�������Ӧ�ȡ�H1��
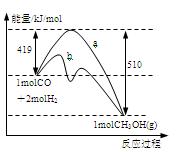
��2����ӦI��һ��������ܱ������н��У����ж����Ƿ�ﵽ��ѧƽ��״̬�������� ��
A��������ѹǿ���� B�����������c��CO������
C��v����H2����v����CH3OH�� D��c��CO����c��CH3OH��
��3��ͼ������ ��ʾʹ�ô���ʱ��Ӧ�������仯��
��4��һ�������£������Ϊ2 L���ܱ������г���2 mol CO2��6 mol H2��һ��ʱ���ﵽƽ��״̬�����CH3OH(g)�����ʵ���Ϊ1mol����������¸÷�Ӧ�Ļ�ѧƽ�ⳣ����
Kֵ= ���÷�����ʾ��������ʼʱ����2 mol CH3OH(g) ��2 mol H2O(g)�ﵽ��ͬƽ��ʱCH3OH��ת����Ϊ ����ƽ����ڳ���4 mol��N2����C(CO2)�� ��
��5������ɫ��ѧ�ĽǶȱȽ��������ַ���������ԭ�Ӿ��õ��� �����I�� ��II����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�콭��ʡ�������С������С�����и����ڶ��ε���������ѧ�Ծ� ���ͣ���ѡ��
�����Ϊ2 L���ܱ������г���2 mol SO2��1 mol O2�������ʼ����ѹǿΪp��һ�������·�����Ӧ��2SO2(g)��O2(g)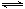 2SO3(g) ��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
2SO3(g) ��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
| A������2 mol SO3��SO2�����ʵ������� |
| B����һ�η�Ӧ�ﵽƽ��ʱ���ų�����176.4 kJ |
| C������2 mol SO3�ﵽ��ƽ��ʱ�������ڵ�ѹǿΪ1.4p |
| D�������������¶ȿ�ʹ��ƽ��ʱ�����ʵ�����������һ��ƽ��ʱ��ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�����ʡ�����и�����ѧ�ڵ�����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��CO2(g) + 3H2(g)  CH3OH(g)
+ H2O(g) ��H����49.0 kJ•mol��1��һ�������£������Ϊ2 L���ܱ������г���2 mol
CO2��6 mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯������ͼ��ʾ�����������У���ȷ����
CH3OH(g)
+ H2O(g) ��H����49.0 kJ•mol��1��һ�������£������Ϊ2 L���ܱ������г���2 mol
CO2��6 mol H2�����CO2��CH3OH(g)��Ũ����ʱ��仯������ͼ��ʾ�����������У���ȷ����

A��10min�������¶���ʹ ����
����
B����Ӧ�ﵽƽ��״̬ʱ��CO2��ƽ��ת����Ϊ75%
C��3 minʱ����CO2��Ũ�ȱ�ʾ������Ӧ���ʵ�����CH3OH��Ũ�ȱ�ʾ���淴Ӧ����
D���ӷ�Ӧ��ʼ��ƽ�⣬H2��ƽ����Ӧ���ʦ�(H2)��0.075 mol��L��1•min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�������С�����и����ڶ��ε���������ѧ�Ծ� ���ͣ�ѡ����
�����Ϊ2 L���ܱ������г���2 mol
SO2��1 mol O2�������ʼ����ѹǿΪp��һ�������·�����Ӧ��2SO2(g)��O2(g)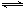 2SO3(g)
��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
2SO3(g)
��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
A������2 mol SO3��SO2�����ʵ�������
B����һ�η�Ӧ�ﵽƽ��ʱ���ų�����176.4 kJ
C������2 mol SO3�ﵽ��ƽ��ʱ�������ڵ�ѹǿΪ1.4p
D�������������¶ȿ�ʹ��ƽ��ʱ�����ʵ�����������һ��ƽ��ʱ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�����ڶ��ε���������ѧ�Ծ� ���ͣ�ѡ����
�����Ϊ2 L���ܱ������г���2 mol SO2��1 mol O2�������ʼ����ѹǿΪp��һ�������·�����Ӧ��2SO2(g)��O2(g) 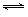 2SO3(g) ��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
2SO3(g) ��H��-196 kJ��mol��1��ά�������¶Ȳ��䣬���ƽ��ʱ������ѹǿΪ0.7p������ʱ���������г���2 mol SO3��������˵����ȷ����
A������2 mol SO3��SO2�����ʵ�������
B����һ�η�Ӧ�ﵽƽ��ʱ���ų�����176.4 kJ
C������2 mol SO3�ﵽ��ƽ��ʱ�������ڵ�ѹǿΪ1.4p
D�������������¶ȿ�ʹ��ƽ��ʱ�����ʵ�����������һ��ƽ��ʱ��ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com