
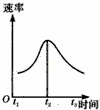
)除去氧化膜的镁条投入到稀盐酸中,H2产生的速率变化情况如图所示:其中t0﹣t1速率变化的主要原因是 ,t1﹣t2速率变化的主要原因是 .
考点: 化学反应速率的影响因素.
专题: 化学反应速率专题.
分析: 金属与盐酸的反应为放热反应,温度升高,随反应进行,浓度减小,结合温度、浓度对反应速率影响来解答.
解答: 解:由图可知,t0~t1段速率增大,是因Mg与HCl(ag)的反应为放热反应,随着溶液温度的升高使反应速率加快;t1~t2段速率减小,是因随着反应的进行,溶液中c(HCl)减小,从而又导致反应速率减小,
故答案为:Mg与HCl(ag)的反应为放热反应,随着溶液温度的升高使反应速率加快;随着反应的进行,溶液中c(HCl)减小,从而又导致反应速率 减小.
减小.
点评: 本题考查影响化学反应速率的因素,为高频考点,把握温度、浓度对反应速率的影响及图象分析为解答的关键,注重分析与知识应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32﹣、SO32﹣、SO42﹣、C1﹣中的若干种,现取X溶液进行连续实验,实验过程及产物如图.下列说法正确的是()
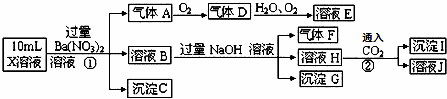
A. 气体A是NO2
B. X中肯定存在Fe2+、A13+、NH4+、SO42﹣
C. 溶液E和气体F不能发生化学反应
D. X中不能确定的离子是 A13+和C1﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
已知前四周期五种元素X、Y、Z、W、T,它们的原子序数依次增大.X是空气中含量最多的元素;Y、W位于同周期,W单质在常温下是黄绿色气体,Y单质在其中燃烧发出黄色火焰;Z的氧化物常用作制备通讯光纤;T是常见金属,在氧气中燃烧可以得到具有磁性的黑色物质.回答下列问题:
(1)Z位于元素周期表中第三周期第ⅣA族;W基态原子核外电子排布式为 .
(2)Y和W的简单离子比较,半径较大的是 (填离子符号);键的极性比较:X﹣H Z﹣H(填“大于”或“小于”);Z单质和其氧化物比较,熔点较高的是 (填化学式).
(3)向T单质与稀硫酸反应后的溶液中滴加足量的NaOH溶液,能观察到的现象是 ;X与Y形成的原子个数比为1:3的简单化合物可与水反应生成两种碱,写出该物质与醋酸溶液反应的化学方程式 .
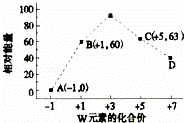
(4)一定条件下,在水溶液中1molW﹣、WO (z=1,2,3,4等)的能量(kJ)相对大小如图所示.
(z=1,2,3,4等)的能量(kJ)相对大小如图所示.
①D点对应的微粒是ClO4﹣(填离子符号).
②写出B→A+C反应的热化学方程式: (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率比乙容器内的反应速率()
A. 快 B. 慢 C. 相等 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)═2C(g),反应2min的时间,并测得该段时间内C的反应速率为0.6mol•L﹣1•min﹣1,现有下列几种说法中正确的是()
①用物质A表示的反应的平均速率为0.6mol•L﹣1•s﹣1
②用物质B表示的反应的平均速率为0.05mol•L﹣1•s﹣1
③2min时容器中A的物质的量为2.8mol
④2min时物质B的浓度为0.4mol•L﹣1.
A. ①③ B. ②④ C. ②③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
能源危机是当前全球问题,开源节流是应对能源危机的重要举措.
(1)下列做法有助于能源“开源节流”的是 (填字母).
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热等新能源,减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
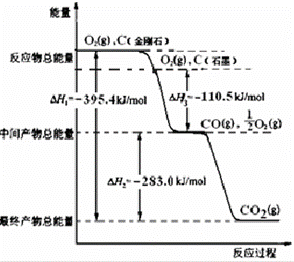
(2)金刚石和石墨均为碳的同素异形体,氧气不足时它们燃烧生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如图所示:
(a)通常状况下,金刚石和石墨中 (填“金刚石”或“石墨”)更稳定,石墨的燃烧热为△H= kJ•mol﹣1.
(b)12g石墨在一定量空气中燃烧,生成气体36g,则该过程共放出的热量 kJ.
(3)已知:N2(g)+O2(g)=2NO(g);△H=+180.0kJ•mol﹣1.综合上述有关信息,请写出用CO除去NO的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
充分燃烧一定量丁烷气体放出的热量为Q,完全吸收它生成的CO2生成正盐,需要5mol•L﹣1 的KOH溶液100mL,则丁烷的燃烧热为()(单位:kJ/mol)
A. 16Q B. 8Q C. 4Q D. 2Q
查看答案和解析>>
科目:高中化学 来源: 题型:
我国成功发射“天宫一号”飞行器的长征Ⅱ火箭推进器中盛有强还原剂肼(N2H4)和强氧化剂液态双氧水(H2O2).当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知此状况下:0.4mol液态肼与足量的液态双氧水反应放出256.0kJ的热量.(已知H2O(l)═H2O(g)△H=+44kJ•mol﹣1)
(1)则16g液态肼与液态双氧水反应在此状况下生成液态水时放出的热量是 kJ.
(2)(2)已知拆开1mol H﹣H键,1mol N﹣H键,1mol N≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积为VL的密闭容器中放入2LA(g)和1L B(g),在一定条件下发生下列反应:3A(g)+B(g)⇌nC(g)+2D(g),达到平衡后,A物质的量浓度减小 ,混合气体的平均摩尔质量增大
,混合气体的平均摩尔质量增大 ,则该反应的化学方程式中n的值是()
,则该反应的化学方程式中n的值是()
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com