
分析 (1)镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,n(H2)=$\frac{7.84L}{22.4L/mol}$=0.35mol,设出金属的物质的量,根据质量、转移电子守恒列方程式计算;
(2)根据HCl和氢气之间的关系式计算盐酸的物质的量,再根据c=$\frac{n}{V}$计算出该盐酸的浓度.
解答 解:(1)镁铝合金与盐酸发生反应的化学方程式为:Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,n(H2)=$\frac{7.84L}{22.4L/mol}$=0.35mol,
设Mg的物质的量为x,Al的物质的量为y,根据金属质量、转移电子守恒列方程式:
$\left\{\begin{array}{l}{24x+27y=7.5}\\{2x+3y=0.35×2}\end{array}\right.$,
解得:$\left\{\begin{array}{l}{x=0.2mol}\\{y=0.1mol}\end{array}\right.$,
答:合金中镁和铝的物质的量分别是0.2mol、0.1mol;
(2)金属与500mL盐酸恰好反应,根据反应关系式2HCl~H2↑可知,500mL该盐酸中含有氯化氢的物质的量为:0.35mol×2=0.7mol,
所以该盐酸的物质的量浓度为:c(HCl)=$\frac{0.7mol}{0.5L}$=1.4mol/L,
答:所使用盐酸的物质的量浓度为1.4mol/L.
点评 本题以镁铝合金为载体考查了混合物反应的计算,题目难度中等,根据各物质之间的关系式结合守恒思想分析解答,试题充分考查了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题

| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g•g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 | 6.5×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构式: | |
| B. | 次氯酸的结构式为:H-Cl-O | |
| C. | 硫离子的核外电子排布式:1s22s22p63s23p6 | |
| D. | NH3的电子式: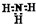 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下0.1mol•L-1的下列溶液中:①NH4Al(SO4)2;②NH4Cl;③CH3COONH4,c(NH4+)由大到小的顺序为②>①>③ | |
| B. | 常温下0.4mol•L-1CH3COOH溶液和0.2mol•L-1NaOH溶液等体积混合后溶液显酸性,溶液中粒子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | 0.1mol•L-1 Na2CO3溶液与0.2mol•L-1NaHCO3溶液等体积混合所得溶液中:c(CO32-)+2c(OH-)═c(HCO3-)+3c(H2CO3)+2c(H+) | |
| D. | 0.1mol•L-1的氨水与0.05mol•L-1H2C2O4溶液等体积混合所得溶液中:c(NH4+)+c(NH3•H2O)═2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com