
【题目】三氯化硼是重要的化工原料。可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】①BCl3的沸点为12.5℃,熔点为-107.3℃;
②2B+6HCl![]() BCl3+3H2 ,硼也能与强碱反应。
BCl3+3H2 ,硼也能与强碱反应。
某研究性学习小组用如下所示装置制备三氯化硼。回答下列问题:
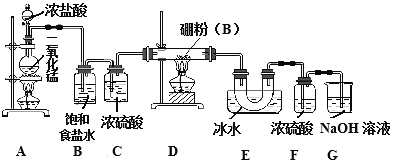
(1)A装置中反应的离子方程式_______________________。
(2)B装置的作用是____________;如果拆去B装置,可能的后果是__________________。
(3)D装置中发生反应的化学方程式_____________。
(4)G装置的作用是_____;为使实验装置简便,可用一个装置代替F和G装置。该装置所用仪器是___,所装试剂是____。
(5)A、D两处加热的先后顺序是_____________,其理由是_______________。
(6)检验制得的产品中是含有硼粉的实验操作是________________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2
Mn2++Cl2↑+2H2O 除去氯气中的氯化氢杂质气体 硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸 2B+3Cl2![]() 2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
2BCl3 吸收未反应完的氯气,防止污染空气 干燥管或U型管 碱石灰 先A处后D处 排尽装置中的空气,避免氧气与硼粉反应生成B2O3 取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉
【解析】(1)装置A制取氯气,因此离子反应方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2
Mn2++Cl2↑+2H2O;(2)盐酸易挥发,制取的氯气中含有氯化氢,B装置的作用是除去氯气中的氯化氢杂质气体;如果拆去B装置,可能的后果是硼粉与氯化氢反应生成的产物中有氢气,加热氢气与氯气的混合气体,易发生爆炸;(3)D装置中发生反应是硼粉与氯气反应生成氯化硼,反应的化学方程式为2B+3Cl2![]() 2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
2BCl3;(4)G装置装有氢氧化钠溶液,其作用是吸收未反应完的氯气,防止污染空气;为使实验装置简便,可用一个装置代替F和G装置,可防止空气中的水蒸气进入E,又能吸收未反应完的氯气,该装置所用仪器是干燥管或U型管,所装试剂是碱石灰;(5)A、D两处加热的先后顺序是先A处后D处,其理由是排尽装置中的空气,避免氧气与硼粉反应生成B2O3;(6)检验制得的产品中是含有硼粉的实验操作是取少量样品于试管中,滴加浓氢氧化钠溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。
【题型】综合题
【结束】
10
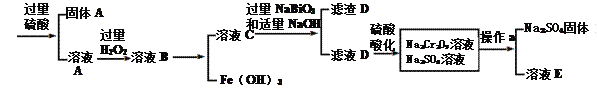
【题目】工业上以铬铁矿(主要成分为FeO·Cr2O3 ,含有Al2O3、SiO2等杂质)为原料生产重铬酸钠Na2Cr2O7·2H2O,其流程如下:
查阅资料得知:
①常温下,NaBiO3难溶于水,有强氧化性。
②常温下,Ksp[Cr(OH)3]=6.4×10-31 Ksp[Fe(OH)3]=4.0×10-38 lg2.5=0.4
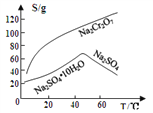
③物质溶解度曲线如图所示。
回答下列问题:
(1)Na2Cr2O7·2H2O铬的价态是____,H2O2的电子式为__________。
(2)NaBiO3的作用__________。
(3)滤渣D的成分是__________。
(4)操作a的名称是________、__________。
(5)电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-。处理该废水的流程为:

①流程中,Na2S2O3参与反应的的离子方程式__________。
②a=_______,Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1];若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为_______。
【答案】 +6 ![]() 作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
作氧化剂,氧化Cr3+ Al(OH)3 蒸发结晶 趁热过滤 3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O 5.6 Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-
【解析】(1)Na2Cr2O7·2H2O中钠的化合价为+1价,氧的化合价为-2价,氢的化合价为+1价,根据化合物中各元素化合价代数和为0可推出铬的价态为+6价,H2O2的电子式为![]() ;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=
;(2)根据已知条件可知,NaBiO3有强氧化性,其作用为作氧化剂,氧化Cr3+;(3)溶液C中加入过量NaBiO3和适量氢氧化钠后溶液pH增大,Al3+转化为沉淀,故滤渣D的成分是Al(OH)3;(4) Na2Cr2O7、Na2SO4混合溶液通过操作a后得到Na2SO4固体和溶液E,溶液E主要含有Na2Cr2O7,故操作a是将溶解度随温度变化情况不同的两溶质从溶液中分离,根据图中溶解度曲线可知,其名称是蒸发结晶、趁热过滤;(5)①流程中,含Cr2O72-的废水中加入Na2S2O3溶液转化为含的Cr3+废水,发生反应的的离子方程式为:3S2O32-+4Cr2O72-+26H+=8Cr3++6SO42-+13H2O;②Cr3+已沉淀完全[此时c(Cr3+)=1×10-5mol·L-1]时, Ksp[Cr(OH)3]=c(Cr3+)×c3(OH-)=1×10-5mol·L-1×c3(OH-)=6.4×10-31,则c3(OH-)=![]() =6.4×10-26,c(OH-)=4.0×10-9,c(H+)=
=6.4×10-26,c(OH-)=4.0×10-9,c(H+)=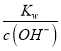 =
=![]() =2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。
=2.5×10-6,pH=-lgc(H+)=5.6,故a=5.6;若pH>a时,Cr(OH)3开始溶解,溶解时的离子方程式为Cr(OH)3 + OH- = CrO2-+ 2H2O或Cr(OH)3 + OH - = Cr(OH)4-。


科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E+原子核外有3层电子且各层均处于全满状态.请填写下列空白.
(1)E元素基态原子的核外电子排布式为 .
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为(填元素符号),其原因为 .
(3)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为;1mol B2A4分子中含molσ键.
(4)已知D、E能形成晶胞如图所示的两种化合物 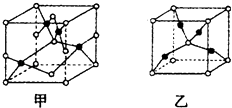 ,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
,化合物的化学式,甲为 , 乙为;高温时,甲易转化为乙的原因为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 2.4g镁在足量的空气中完全燃烧时消耗O2分子的数目为0.1NA
B. 1 molFe溶于过量硝酸,电子转移数为3NA
C. 14 g乙烯和丙烯混合气体含有碳碳双键数目为2NA
D. 5.6L二氧化碳气体中含有的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物理量与其单位匹配正确的是( )
A.质量﹣﹣g
B.反应速率﹣﹣molL﹣1
C.摩尔质量﹣﹣gmol﹣1
D.气体摩尔体积﹣﹣Lmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是 ( )
A.硅是制造太阳能电池的常用材料
B.二氧化硅是制造光导纤维的材料
C.常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应
D.水玻璃可用作木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验:

(1)仪器a的名称为________,装置A的圆底烧瓶中发生反应的化学方程式为________,为保持装置C为无水环境,装置B中加入的试剂是________。
(2)实验步骤:如图连接装置后,先________(填实验操作),再装药品,然后点燃________(填“A”或“C”)处酒精灯,当________(填实验现象)时,再点燃________(填“A”或“C”)处酒精灯。
(3)装置D的作用是________,________。
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________(填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是氮循环的一部分: 
(1)通常状况下,NO2的颜色是;
(2)反应①的化学方程式是;
(3)NO2易溶于水,并和水发生化学反应.该反应中,氧化剂是;
(4)化合物A的化学式是;
(5)治理汽车尾气的一种方法是用催化剂使NO与CO发生反应:2NO+2CO═2CO2+N2 . 当生成2mol N2时,被还原的NO为mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com