
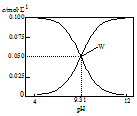
| A. | 将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化):c(Na+)>c(HCN)>c(CN-)>c(OH-)>c(H+) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(HCN) | |
| C. | pH=8的溶液中:c(Na+)+c(H+)+c(HCN)=0.1mol•L-1+c(OH-) | |
| D. | 将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化):c(CN-)+3c(OH-)=2c(HCN)+3c(H+) |
分析 A.根据图知,将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化),混合溶液的pH=9.31>7,说明溶液呈碱性,则NaCN水解程度大于HCN电离程度;
B.W点表示溶液中c(HCN)=c(CN-)=0.05mol•L-1,溶液中存在电荷守恒,根据电荷守恒判断;
C.c(Na+)+c(H+)+c(HCN)=c(HCN)+c(CN-)+c(OH-);
D.将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化),溶液中存在物料守恒和电荷守恒,根据物料守恒和电荷守恒判断.
解答 解:A.根据图知,将0.1 mol•L-1的HCN溶液和0.1 mol•L-1NaCN溶液等体积混合(忽略溶液体积变化),混合溶液的pH=9.31>7,说明溶液呈碱性,则NaCN水解程度大于HCN电离程度,所以存在c(Na+)<c(HCN),故A错误;
B.W点表示溶液中c(HCN)=c(CN-)=0.05mol•L-1,溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(CN-)+c(OH-)=c(HCN)+c(OH-),故B错误;
C.c(Na+)+c(H+)+c(HCN)=c(HCN)+c(CN-)+c(OH-)=0.1mol•L-1+c(OH-),故C正确;
D.将0.3 mol•L-1HCN溶液和0.2 mol•L-1NaOH溶液等体积混合(忽略溶液体积变化),溶液中存在物料守恒和电荷守恒,根据物料守恒得3c(Na+)=2c(HCN)+2c(CN-),根据电荷守恒得(Na+)+c(H+)=c(CN-)+c(OH-),所以得c(CN-)+3c(OH-)=2c(HCN)+3c(H+),故D正确;
故选CD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析判断能力,正确进行等量代换是解本题关键,注意A中HCN电离程度小于NaCN水解程度,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 11.1% | C. | 0.1% | D. | 20% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
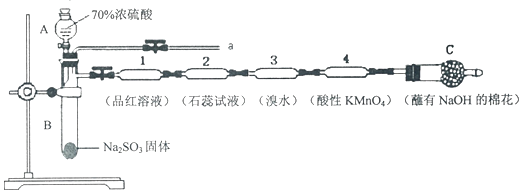
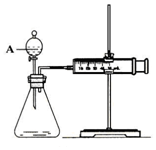 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0,7克镁带,按图连接好装置,从A中加入20.0ml0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.记录数据如表| 时间/s | 0 | t | 2t | … |
| 活塞的位置/ml | 17.3 | 25.6 | 36.6 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
 .
.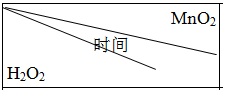 | 0.1g | 0.3g | 0.8g |
| 10mL1.5% | 223s | 67s | 36s |
| 10mL3.0% | 308s | 109s | 98s |
| 10mL4.5% | 395s | 149s | 116s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
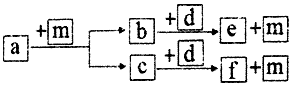 短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 简单离子半径:Z>Y | |
| B. | Z2Y2中既含有离子键又含有共价键,其中阳离子和阴离子的比值为2:1 | |
| C. | 简单气态氢化物的热稳定性:Y>X | |
| D. | 由上述4种元素组成的化合物属于离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl- | |
| B. | 在pH=12的溶液中:Na+、AlO2-、NO3-、S2- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 加入Mg能放出H2的溶液中:Mg2+、NH4+、ClO-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
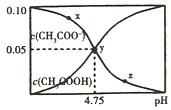 常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )
常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如图,则下列说法不正确的是( )| A. | 溶液的pH比较:x>y>z | |
| B. | 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| C. | 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点 | |
| D. | 该温度下,CH3COONa的Kb=10-4.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,将1mol N2和3mol H2混合发生反应,转移的电子总数为6NA | |
| B. | 30g SiO2中含有的硅氧键数为NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有2mol Fe2+被氧化时,消耗Cl2的分子数为NA | |
| D. | 取50 mL 14.0 mol•L-1 浓硝酸与足量的铜片反应,生成气体分子的数目可能为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| D. | 向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com