
【题目】以菱锰矿(主要成分MnCO3,还含有FeCO3、CaCO3、SiO2、Al2O3、Fe2O3、MgCO3等杂质)为原料制备二氧化锰的工艺流程如下:
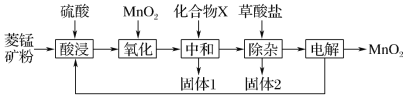
已知草酸钙、草酸镁不溶于水。
(1)写出“氧化”时发生反应的离子方程式:__________________________________________。
(2)“中和”的目的是将铁、铝元素转化为沉淀除去,化合物X可用______________________(写一种物质的化学式)。
(3)该工艺流程中固体1和固体2均需用水洗涤,目的是______________________。
(4)“除杂”时,除去的金属离子有______________________________________。
(5) 该流程中可以循环使用的物质有________。
(6)电解过程中MnO2 在______(填“阴”或“阳”)极生成。
【答案】MnO2+2Fe2++4H+=Mn2+ +2Fe3++2H2O CaCO3(或MnCO3等合理答案均可) 用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率(或用水洗涤滤渣,洗出液循环利用,提高锰的回收率等合理答案均可) Ca2+、Mg2+ H2SO4、MnO2 阳
【解析】
菱锰矿粉加入硫酸酸浸,得到亚铁离子、铁离子、钙离子、铝离子、镁离子的溶液,加入二氧化锰,将亚铁离子氧化成铁离子,加入化合物X中和硫酸,“中和”的目的是将铁、铝元素转化为沉淀除去,为了不引入新的杂质,结合实验目的,X可以为碳酸锰等;得到氢氧化铁和氢氧化铝的沉淀,加入草酸盐,得到草酸钙和草酸镁的沉淀和硫酸锰的溶液,通过电解硫酸锰溶液,最终得到产品二氧化锰和硫酸,据此分析解答。
(1)酸浸后,溶液中含有亚铁离子,亚铁离子能被二氧化锰氧化,得到三价铁离子和二价锰离子,故反应的离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)中和的目的是将铁离子与铝离子转化成沉淀,过滤除去,在此过程中,要除去杂质又不能引入新的杂质,阳离子为锰离子、钙离子、镁离子,故化合物X可以为MnCO3或CaCO3等,故答案为:MnCO3或CaCO3等;
(3)过滤得到的沉淀表面含有滤液中的离子,因此,在流程中要用水洗涤滤渣,洗出液可用于回收,或利用在酸浸操作,加大物质的利用率,提高锰的回收率,故答案为:用水洗涤滤渣,洗出液用于酸浸工序,提高锰的回收率;
(4)已知草酸钙、草酸镁不溶于水,则除杂时除去的就是Ca2+和Mg2+,故答案为:Ca2+和Mg2+;
(5)硫酸锰电解生成二氧化锰和硫酸,酸浸操作要用到硫酸,氧化过程用到二氧化锰,故该流程中可以循环使用的物质有H2SO4、MnO2,故答案为:H2SO4、MnO2;
(6)根据电解原理,阳极发生氧化反应,阴极发生还原反应,锰离子失去电子转化为二氧化锰,发生氧化反应,应该在阳极上发生,故答案为:阳。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
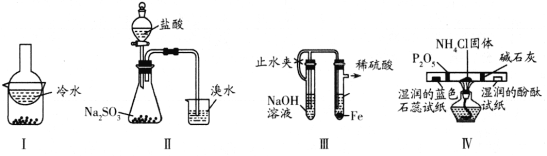
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下[已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1],下列说法正确的是( )
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1 mol N2、 3 mol H2 | 2 mol NH3 | 4 mol NH3 |
NH3的浓 度/mol·L-1 | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A. 2c1>c3B. α1+α3<1C. 2p2<p3D. a+b>92.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1) 除去KNO3中混有的SO42-应选择的除杂试剂为__________;
(2) 向沸腾的蒸馏水中滴加饱和FeCl3溶液可制取Fe(OH)3胶体,用化学方程式表示该方法的原理:_______;
(3) 在水溶液中,KHSO4的电离方程式为:______________________________;
(4) 盐酸与氢氧化钠溶液反应的离子方程式为:__________________________;
(5) CO2与足量澄清石灰水反应的离子方程式:__________________________;
(6) 硫酸铜溶液与氢氧化钡溶液反应的离子方程式为:____________________ ;
(7)小苏打常作为食品制作过程中的膨松剂,其溶液与稀HNO3反应的离子方程式为:___;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如图:
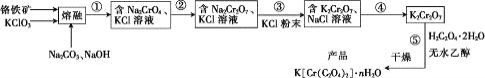
回答下列问题:
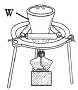
(1)“熔融”的装置如图,坩埚W的材质可以是________(填“铁”“陶瓷”或“玻璃”);FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为_______________。
(2)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等,步骤①的具体步骤为水浸,过滤,调pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为________,“调pH为7~8,加热煮沸半小时”的目的是__________。
(3)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为________。
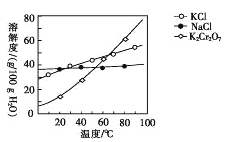
(4)步骤④包含的具体操作有____,经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)
(5)步骤⑤需往两种固体混合物中加入一滴水及少量酒精研磨,所用的硅酸盐质仪器的名称是________。
(6)采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H=﹣1269kJ/mol
②
下列说法正确的是
A. 断开1 mol O﹣O键比断开1 mol N﹣N键所需能量少448kJ
B. 断开1 mol H﹣O键比断开1 mol H﹣N键所需能量相差约72.6kJ
C. 由以上键能的信息可知H2O的沸点比NH3高
D. 由元素非金属性的强弱可知 H一O键比H一N键弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g)2SO3(g) △H<0的影响如图所示,下列说法正确的是( )
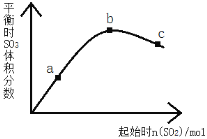
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D. a、b、c三点的平衡常数Kb>Kc>Ka
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
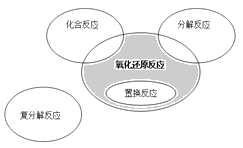
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4NH3+5O2 4NO+6H2O
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,不正确的是
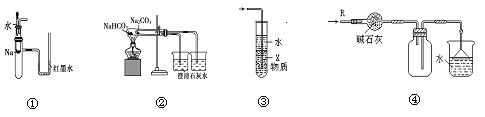
A.装置①可用于验证Na与H2O反应是否放热
B.装置②可用于比较Na2CO3与NaHCO3的稳定性
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com