
【题目】下列反应中,调节反应条件以后,反应产物不会改变的是
A. 钠与氧气 B. NaOH溶液和Al2(SO4)3溶液
C. 盐酸与铁粉 D. 二氧化碳与氢氧化钠溶液
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁均为中学化学常见的纯净物,它们之间有如下图所示的反应关系。下列物质组不满足上述转化关系的是
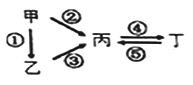
选项 | 甲 | 乙 | 丙 | 丁 |
A | Fe | FeCl2 | FeCl3 | Fe(OH)3 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | Na | Na2O | Na2O2 | NaOH |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器的选用正确的是( )
A.称量10.56gNa2CO3固体——用托盘天平
B.准确量取10.00mL的溶液——用10mL量筒
C.灼烧干海带至完全变成灰烬——用蒸发皿
D.过滤煮沸后的硬水——用普通漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体。因此,控制和治理CO2是解决温室效应的有效途径。
(1)下列措施中,有利于降低大气中CO2浓度的有:_________。(填字母)
a.减少化石燃料的使用 b.植树造林,增大植被面积
c.采用节能技术 d.利用太阳能、风能
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2 + 6H2O![]() C6H12O6 b.CO2 + 3H2
C6H12O6 b.CO2 + 3H2![]() CH3OH +H2O
CH3OH +H2O
c.CO2 + CH4![]() CH3COOH d.2CO2 + 6H2
CH3COOH d.2CO2 + 6H2![]() CH2==CH2 + 4H2O
CH2==CH2 + 4H2O
以上反应中,最节能的是_____________,原子利用率最高的是____________。
(3)文献报道某课题组利用CO2催化氢化制甲烷的研究过程如下:
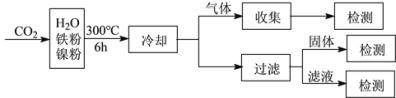
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。
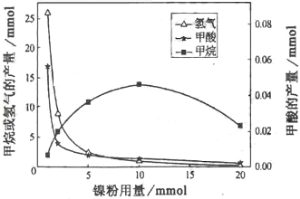
CH4、HCOOH、H2的产量和镍粉用量的关系如下图所示(仅改变镍粉用量,其他条件不变):
研究人员根据实验结果得出结论:
HCOOH是CO2转化为CH4的中间体,即:CO2![]() HCOOH
HCOOH![]() CH4
CH4
①写出产生H2的反应方程式_______________________________________。
②由图可知,镍粉是_______。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应ⅠⅡ的催化剂
d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是__________。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应ⅠⅡ的速率均不变
d.反应ⅠⅡ的速率均增加,且反应Ⅰ的速率增加得快
e.反应ⅠⅡ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4·2H2O)可用于制备磷酸铁锂电池正极材料。实验室制备草酸亚铁并测定其组成的实验流程如下:

(1) “溶解”时加热的目的是_____________________;“沉铁”时将溶液煮沸并在不断搅拌下加入H2C2O4溶液,“不断搅拌”除可使反应物充分接触外,另一目的是_____________________。
(2) “过滤、洗涤”时,能说明沉淀已洗涤干净的依据是_____________________。
(3)按以下步骤可以测定产品中草酸根的质量分数。
①称取0.1600g草酸亚铁于锥形瓶中,加入25mL2mol·L-1的H2SO4溶液,加热至40~50℃,使样品溶解。
②用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液23.80mL。
[5C2O![]() +2MnO
+2MnO![]() +16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO
+16H+=10CO2↑+2Mn2++8H2O;5Fe2++MnO![]() +8H+=5Fe3++Mn2++4H2O]
+8H+=5Fe3++Mn2++4H2O]
③在②滴定后的溶液中加入足量Zn粉(2Fe3++Zn = 2Fe2++Zn2+)和5mL2mol·L-1 的H2SO4溶液,煮沸约10min。
④将滤液过滤至另一个锥形瓶中,用10mL1mol·L-1的H2SO4溶液洗涤锥形瓶,将全部Fe2+转移入锥形瓶中,再用0.02000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积8.00 mL。
(I)测得的产品中n(Fe![]() ) ∶n(C2O
) ∶n(C2O![]() ) _________1∶1(填“>” “=”或“<”)。
) _________1∶1(填“>” “=”或“<”)。
(II)请计算产品中C2O![]() 的质量分数(写出计算过程)。______________
的质量分数(写出计算过程)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于A中生成的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
(猜想)甲组:黑色物质是FeO
乙组:黑色物质是Fe3O4
丙组:_____________;
(实验探究)
(1)丙组认为一种简单定性的方法即可判断甲组的正误:取A中生成的黑色物质少许于烧杯,加稀盐酸使其完全溶解,再加______溶液以检验Fe3+,观察到溶液有无出现_________现象即可判断。
(2)乙组认为可通过定量测定来确定A中生成的黑色物质的组成,以验证该组猜想正确。取A中生成的黑色物质2.32g溶解于适量稀盐酸后,加入新制氯水,加入氯水后反应的离子方程式为:_____________,再加入足量NaOH溶液后,过滤洗涤烘干灼烧称量,若称得固体质量为________,即可判断乙组同学猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应KClO3 + 6HCl= 3Cl2↑+KCl + 3H2O,下列有关的说法中,正确的是( )
A. HCl 中的Cl 全部被氧化 B. 失电子的氯原子是得电子的氯原子的5倍
C. 反应中有6mol电子发生转移 D. 反应中KClO3 被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl![]() NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
NaCl+N2↑+2H2O;关于该反应的下列说法不正确的是( )
A. Na2NO2是氧化剂,NH4Cl是原剂
B. N2既是氧化产物,又是还原产物
C. NH4Cl中氮元素被还原
D. 每生成1molN2转移电子的物质的量为3mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com