
| A. | CaCl2易吸收空气中的水分 | |
| B. | Ca(ClO)2见光易分解 | |
| C. | Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO | |
| D. | Ca(ClO)2易被空气中的氧气氧化 |
分析 漂白粉的有效成分为Ca(ClO)2,由于HClO的酸性比碳酸弱,Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解.
解答 解:次氯酸酸性小于碳酸,次氯酸钙和二氧化碳、水反应生成次氯酸,次氯酸不稳定,光照易分解,导致漂白粉失效,反应方程式为Ca(ClO)2+C02+H20=2HClO+CaC03、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+02↑,
A.氯化钙不是漂白粉的有效成分,吸收水蒸气不变质,故A错误;
B.次氯酸钙见光不分解,故B错误;
C.Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO,次氯酸见光分解,使漂白粉变质,故C正确;
D.次氯酸钙是强氧化剂不能被空气中的氧气氧化,故D错误;
故选C.
点评 本题考查次氯酸钙的性质,为高频考点,侧重双基的考查,题目难度不大,注意HClO的酸性、不稳定性是决定漂白粉失效的主要原因.


科目:高中化学 来源: 题型:选择题
| A. | 化学键存在于原子之间,也能存在于分子与离子之间 | |
| B. | 两个原子之间的相互作用叫做化学键 | |
| C. | 离子键是阴、阳离子之间的吸引力 | |
| D. | 化学键通常指的是任意两个或多个原子之间强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为正极,Ag2O为负极 | B. | 锌为负极,Ag2O为正极 | ||
| C. | 原电池工作时,Ag2O发生氧化反应 | D. | 原电池工作时,负极区溶液PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质水解反应:HCO3-+H2O?H3O++CO32- | |
| B. | 离子浓度关系:c(Na+)+c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3-+c(CO32-)] | |
| D. | 微粒浓度关系:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
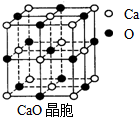 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如:
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如: ,其中碳氧原子之间共价键是c(填序号):
,其中碳氧原子之间共价键是c(填序号):查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com