
| A. | A和B元素一定都是第二周期元素 | B. | A和B元素一定是同一主族元素 | ||
| C. | B元素可以是第二周期VIA族元素 | D. | A和B可以相互化合形成化合物 |
分析 A元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;B元素原子次外层是最外层电子数的2倍,若有2个电子层,最外层电子数为1,则B为Li,若有3个电子层,最外层电子数为4,则B为Si,据此解答.
解答 解:A元素原子最外层电子数是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故A为O元素;B元素原子次外层是最外层电子数的2倍,若有2个电子层,最外层电子数为1,则B为Li,若有3个电子层,最外层电子数为4,则B为Si.
A.A为O元素,处于第二周期,若B为Si时,处于第三周期,故A错误;
B.A为ⅥA族元素,B为IA族或ⅣA族元素,故B错误;
C.B为Li或Si,处于第二周期IA族或第三周期ⅥA族,故C错误;
D.A和B可以相互化合形成化合物Li2O或SiO2,故D正确,
故选D.
点评 本题考查原子结构与位置关系,注意根据核外电子排布判断元素,侧重对基础知识的巩固.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
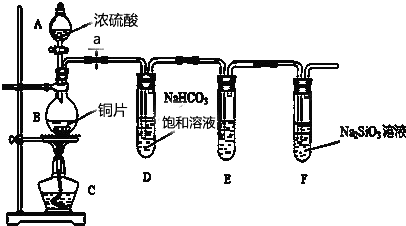
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


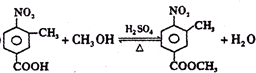 ,使用过量CH3OH的作用是提高D的产率.
,使用过量CH3OH的作用是提高D的产率.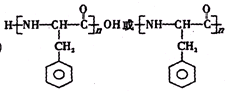 .
.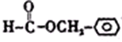 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
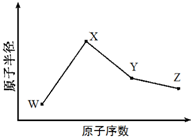 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小. (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{4}{5}$v(A)=V(B) | B. | $\frac{5}{6}$v(B)=v(D) | C. | $\frac{2}{3}$v(A)=V(D) | D. | $\frac{4}{5}$v(B)=v(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
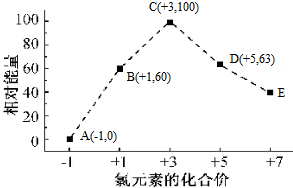
| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com