
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积大 | |
| C. | 一定温度下,反应2Mg(S)+CO2(g)=2MgO(S)+C(s)能自发进行,则该反应△H<0 | |
| D. | 常温时,0.1mol•L-l CHCOOH 溶液加水稀释,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 |
分析 A.电解精炼铜时阳极为粗铜,阴极为纯铜;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,根据n=C×V比较二者的体积关系;
C.反应自发进行的判断依据是△H-T△S<0;
D.醋酸电离平衡常数随温度变化;
解答 解:A.电解法精炼铜时,阳极失去电子发生氧化反应,则以粗铜作阳极,纯铜作阴极,故A错误;
B.醋酸为弱酸,pH均为2的盐酸和醋酸溶液,两种溶液中H+离子浓度相等,则醋酸浓度大与盐酸,设盐酸的浓度为C1,醋酸的浓度为C2,则C1<C2,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗的两种酸的物质的量相等,则有:n=C1V1=C2V2,因C1<C2,所以:V1>V2,消耗盐酸的体积更大,故B正确;
C.一定温度下,反应2Mg(S)+CO2(g)=2MgO(S)+C(s)能自发进行,△H-T△S<0,△S<0,则该反应△H<0,故C正确;
D.常温时,0.1mol•L-l CHCOOH 溶液加水稀释促进电离,电离平衡常数不变,比值$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$,不随浓度变化,比值不变,故D正确;
故选A.
点评 本题考查了弱电解质电离平衡影响因素、电离平衡常数的计算、反应蒸发进行的判断,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
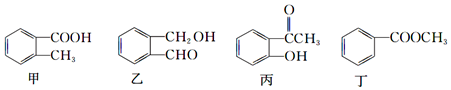
| A. | 甲:①②③④⑥⑦ | B. | 乙:①②③⑤⑥⑦ | C. | 丙:①②③④⑤⑥⑦ | D. | 丁:②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
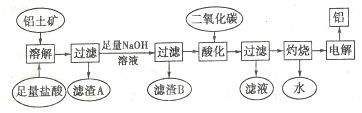
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用浓硫酸 | B. | 加热 | ||
| C. | 加入少量CuSO4固体 | D. | 将铁块改成铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
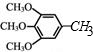 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: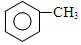 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$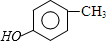 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$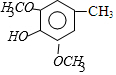 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
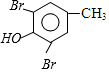 ,C的结构简式为
,C的结构简式为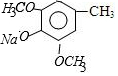 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应属于取代反应 | |
| B. | 乙烯和溴水反应属于取代反应 | |
| C. | 乙醇和酸性高锰酸钾溶液反应属于氧化反应 | |
| D. | 苯燃烧属于氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com