
分析 (1)水溶液中或熔融状态下能够导电的化合物称为电解质,包括酸、碱、盐都是电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;根据电解质的强弱以及结构来分析其电离方程式;
(2)①氧化还原反应是有化合价升降的反应,据此分析;
②Fe+CuSO4═Cu+FeSO4中,Fe元素的化合价升高,Cu元素的化合价降低,以此来解答.
解答 解:(1)A.NaOH固体在水溶液中和熔融状态下能导电,故为电解质,电离方程式为:NaOH=Na++OH-;
B.干冰(固态的二氧化碳)在水溶液中导电和其本身无关,在熔融状态下不导电,故为非电解质;
C.冰醋酸(纯净的醋酸CH3COOH)在水溶液中能导电,故为电解质,电离方程式为:CH3COOH?CH3COO-+H+;
D.氨水是混合物,既不是电解质也不是非电解质;
E.蔗糖(C12H22O11)在水溶液中和熔融状态下均不导电,故为非电解质;
F.Cu是单质,既不是电解质也不是非电解质.
故答案为:AC;BE;NaOH=Na++OH-、CH3COOH?CH3COO-+H+;
(2)①氧化还原反应是有化合价升降的反应,
A.NO+NO2+2NaOH═2NaNO3+H2O中氮元素发生了化合价的变化,故为氧化还原反应;
B.NH3+HCl═NH4Cl无化合价变化,故为非氧化还原反应;
C.Br2+2KI═I2+2KBr有化合价升降,故为氧化还原反应;
D.2H2O2═2H2O+O2↑有化合价升降,故为氧化还原反应.
故答案为:ACD;
②A.Fe元素的化合价升高,则Fe为还原剂,故A错误;
B.Cu元素的化合价降低,则CuSO4是氧化剂,故B错误;
C.Fe元素的化合价升高,失去电子被氧化,故C正确;
D.CuSO4是氧化剂,被还原,CuSO4发生还原反应,故D错误;
故选C.
点评 本题考查了电解质、非电解质的区分和氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 以下说法正确的是( )
以下说法正确的是( )| A. | ③④⑥ | B. | ①②③ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .写出A与溴水的反应方程式
.写出A与溴水的反应方程式 +3Br2→
+3Br2→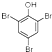 ↓+3HBr
↓+3HBr 或
或 (任写一个).
(任写一个). .
. 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO溶解在稀盐酸中:O2-+2H+═H2O | |
| B. | 硫酸溶液中滴加氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g•mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.a、b、c、d各点反应速率最快的是( )
把0.1molMnO2粉末加入50ml过氧化氢的溶液里(密度为1.1g•mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.a、b、c、d各点反应速率最快的是( )| A. | a | B. | b | C. | c | D. | d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com