
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol?L-1) | 0.64 | 0.二0 | 0.二0 |
| C(CH她OCH她)?c(H2O) |
| c2(CH她OH) |
| 0.一×0.一 |
| 0.02 |


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
A.Mg片作负极,电极反应:Mg-2e- Mg2+ Mg2+ |
B.Al片作负极,电极反应:Al+4OH--3e- AlO2-+2H2O AlO2-+2H2O |
| C.电子从Mg电极沿导线流向Al电极 |
| D.Mg片上有气泡产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
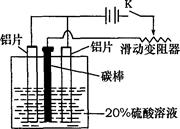
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.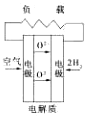 固化氧化物燃料电池 | B.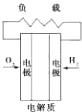 碱性氢氧化物电池 |
C.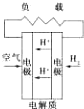 质子交换膜燃料电池 | D. 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 放电 |
| 充电 |
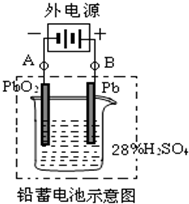
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
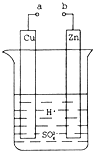
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.由于Ksp(BaSO4)<Ksp(BaCO3),因此不可能使BaSO4沉淀转化为BaCO3沉淀 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的核外电子排布----元素的金属性强弱 |
| B.化合物的内在结构----电解质的相对强弱 |
| C.反应温度的高低----化学平衡的移动程度 |
| D.反应物的化学性质----化学反应速率的快慢 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数 N2O4(g)达到平衡时NO2的体积分数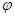 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大 将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com