
| A.NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32- |
| B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O |
| C.氧化铜溶于浓硝酸:CuO+2H+=Cu2++2H2O |
| D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.大理石溶于醋酸:CaCO3+2H+= CO2↑+Ca2++ H2O |
| B.FeBr2溶液中通入少量的Cl2 Cl2 +2Fe2+="2" Fe3++2Cl- |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++ SO42-+Ba2++2OH-= BaSO4↓+2 H2O |
| D.酸性氢氧燃料电池的正极反应:H2-2e-=2H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
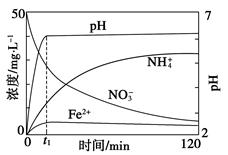
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
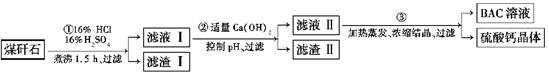
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.Cu与浓硝酸反应制NO2:Cu+4HNO3(浓)=Cu2++2NO3-+2NO2↑+2H2O |
| C.向Na2SiO3溶液中通入过量CO2:SiO32-+ CO2 +H2O =H2SiO3↓+ CO32- |
| D.将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-= BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| B.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O |
C.大理石溶于醋酸中的反应:CaCO3+2H+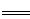 Ca2++H2O+CO2↑ Ca2++H2O+CO2↑ |
D.等物质的量的NaHCO3和Ca(OH)2溶液混合:2 HCO3-+Ca2++2OH- CaCO3↓+ CO32-+2H2O CaCO3↓+ CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
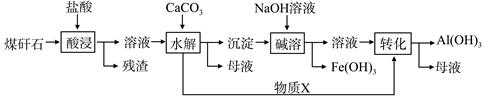
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cl2通入石灰乳中制漂白粉的离子方程式: Cl2+2OH-=Cl-+ClO-+H2O |
| B.利用泡沫灭火器灭火时发生的反应:2Al3++CO32-+3H2O=2Al(OH)3↓+CO2↑ |
| C.已知离子的还原性:Sn2+>Fe2+,则可推测在溶液中能发生如下反应:Sn4++2Fe2+=2Fe3++Sn2+ |
D.298 K时,已知12 g石墨完全燃烧生成CO2(g)放出393.5 kJ热量,1 mol CO完全燃烧放出283.5 kJ热量,则一定有:C(s,石墨)+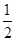 O2(g)=CO(g) ΔH=-110 kJ·mol-1 O2(g)=CO(g) ΔH=-110 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 已知 | 类推 |
| A | 向次氯酸钙溶液中通CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B | 用惰性电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ | 用铜电极电解硫酸铜溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C | 稀硫酸与Ba(OH)2溶液反应,pH=7时,2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O | 硫酸氢钠溶液与Ba(OH)2溶液反应,pH=7时,2H++SO42—+Ba2++2OH-=BaSO4↓+2H2O |
| D | Ba(OH)2溶液逐滴滴入硫酸铝钾溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+AlO2—+2H2O | Ba(OH)2溶液逐滴滴入硫酸铝铵溶液至沉淀质量达到最大值:2Ba2++4OH-+Al3++2SO42—=2BaSO4↓+AlO2—+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com