
| A、用过滤的方法得到食盐水中的NaCl |
| B、用蒸发的方法从碳酸钙的悬浊液总提取碳酸钙 |
| C、用蒸发的方法得到海水中的水 |
| D、对医用酒精进行蒸馏操作可以得到更高纯度的酒精溶液 |


科目:高中化学 来源: 题型:
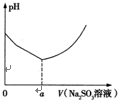 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
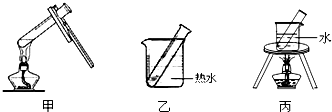
| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有① |
| B、只有③ |
| C、①②③的混合物 |
| D、①②③④的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | 单质是淡黄色固体 | ||
| X | 在地壳中的含量居第二位 | ||
| Y | 原子最外层电子数是电子总数的
| ||
| Z | 第三周期原子半径最小的金属 |
| A、气态氢化物的热稳定性:X<W |
| B、最高价氧化物对应水化物的酸性:Y>X |
| C、离子半径:Z>W |
| D、Y的氧化物中含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com