
| A. | 0.5mol?L-1K2SO4含有的K+数目为NA | |
| B. | 56g铁与足量的盐酸反应时失去电子的数目为3NA | |
| C. | 在标准状况下,22.4LCCl4中含有的分子数目为NA | |
| D. | 在常温常压下,16gO2和O3的混合气体所含原子数目为NA |
分析 A.缺少硫酸钾的体积,无法计算硫酸钾的物质的量;
B.铁与盐酸反应生成氯化亚铁,56g铁的物质的量为1mol,完全反应失去2mol电子;
C.标准状况下,四氯化碳的状态不是气体;
D.氧气和臭氧中都只含有氧元素,16g氧气和臭氧的混合物中含有16个氧原子,根据n=$\frac{n}{M}$计算出含有的氧原子数目.
解答 解:A.没有告诉硫酸钾溶液的体积,无法计算溶液中含有钾离子的物质的量及数目,故A错误;
B.56g铁的物质的量为:$\frac{56g}{56g/mol}$=1mol,1molFe与足量的盐酸反应时失去2mol电子,失去电子的数目为2NA,故B错误;
C.标准状况下,四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故C错误;
D.16gO2和O3的混合气体中含有16个氧原子,含有氧原子的物质的量为:$\frac{16g}{16g/mol}$=1mol,所含原子数目为NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,明确标准状况下气体摩尔体积的使用条件.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO=═2Fe+3CO2△H=-28.5 kJ•mol-1 | |
| B. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-28.5 kJ | |
| C. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=+28.5 kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶液检验FeCl2是否已被氧化而变质 | |
| B. | 用焰色反应鉴别NaCl和KCl | |
| C. | 用加热法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | 用NaOH溶液除去MgCl2溶液中的CuCl2杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,立即用水灭火 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处走 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 大理石投入稀硝酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 氨水与硫酸铝溶液混合:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| D. | 氯水通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A | 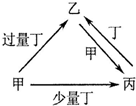 | NaOH | NaHCO3 | Na2CO3 | CO2 |
| B | C | CO | CO2 | O2 | |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
| D | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、SO42-、OH- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | K+、Ca2+、Cl-、MnO4- | D. | Na+、CO32-、SO42-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com