
在硫酸钠和碳酸钠的混合物4.96 g中加入足量的4.80%的盐酸(密度为1.02 g/mL),充分反应后,在标准状况下收集到0.448 L二氧化碳。试求:
(1)混合物中碳酸钠的物质的量。
(2)混合物中硫酸钠的质量分数(保留两位小数)。
(3)盐酸的物质的量浓度(保留两位小数)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
在5L的密闭容器中进行下述反应 ,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
铜-锌原电池如右图所示,下列叙述正确的是 ( )
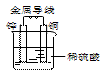
A. 氢离子在负极得电子
B. 锌为负极,发生氧化反应
C. 铜片上无气泡产生
D. 电子从铜片经金属导线流向锌片
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是指导我们系统学习化学的重要工具。下表是元素周期表的一部分:
| C | N | O | F |
| Si | P | S | Cl |
| Br | |||
| I |
(1)从原子结构角度分析,C、N、O、F四种元素处于同一行,是由于它们的_______________相同,处于同一列的N和P位于元素周期表的第__________族。
(2)通过元素周期表,我们可以知道:
①氮元素的最低化合价为___________,其气态氢化物的结构式为_________________。
②原子半径:r(P)_________r(S)(填“>”、“<”或“=”)。
③在上表所列元素的最高价氧化物对应水化物中酸性最强的是___________(写化学式),
写出硝酸的电离方程式______________________________________________。
④Cl的非金属性________(填“强于”、“弱于”或“等于”)Br的非金属性,海水提溴的原理是用氯气将溴离子氧化,请写出氯气与溴化钠溶液反应的化学方程式,并标出电子转移的方向和数目。
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将Na2O2逐渐加入到含有Al3+、Mg2+、NH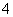 的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH
的混合液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如下图所示,则原混合液中Al3+、Mg2+、NH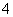
 的物质的量分别是
的物质的量分别是
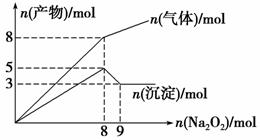
A.2 mol、3 mol、4 mol B.2 mol、3 mol、8 mol
C.3 mol、2 mol、8 mol D.3 mol、2 mol、4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
通过观察化学实验现象,分析归纳出正确的结论,是学习化学科学最基本的技能之一。下列由实验现象得出正确结论的是
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 氢氧化铝能溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试剂中,不能使Fe2+转化为Fe3+的是
①氯气 ②NaCl溶液 ③KMnO 4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
4溶液 ④稀硝酸 ⑤盐酸 ⑥NaNO3溶液
A.①②③ B.①③④
C.②④⑤ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,NO(g)+CO(g) 
 N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1。达到平衡后,为了提高该反应的速率和NO的转化率,采取的措施正确的是( )
N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1。达到平衡后,为了提高该反应的速率和NO的转化率,采取的措施正确的是( )
A、加催化剂,同时升高温度
B、加催化剂,同时增大压强
C、升高温度,同时充入N2
D、降低温度,同时增大压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com