
| A. | Na+的结构示意图为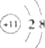 | |
| B. | 纯碱的化学式为Na2CO3 | |
| C. | 在酸性条件下,蔗糖水解的化学方程式为C12H20O11+H2O→2C6H12O6(葡萄糖) | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+7 |
分析 A.钠离子的核电荷数为11,核外电子总数为10,最外层含有8个电子;
B.碳酸钠的俗名为纯碱、苏打,化学式为Na2CO3;
C.蔗糖水解生成葡萄糖和果糖;
D.高氯酸为氯元素的最高价氧化物对应的水化物,Cl元素的化合价为+7价.
解答 解:A.钠离子的核电荷数为11,最外层达到8电子稳定结构,Na+的结构示意图为: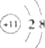 ,故A正确;
,故A正确;
B.纯碱为碳酸钠的俗名,其化学式为:Na2CO3,故B正确;
C.在酸性条件下,蔗糖水解生成葡萄糖和果糖,正确的化学方程式为:C12H20O11+H2O→C6H12O6(葡萄糖)+C6H12O6(果糖),故C错误;
D.高氯酸(HClO4)中氧元素化合价为-2价,H元素的化合价为+1,则Cl元素的化合价为+7价,故D正确;
故选C.
点评 本题考查了常见化学用语的判断,题目难度中等,涉及化学式、离子结构示意图、化学方程式、元素化合价的计算等知识,熟练掌握常见化学用语的概念及书写原则为解答关键,试题培养了学生规范答题的能力.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
常温时,下列混合溶液的pH 一定小于7的是( )
A.pH = 3的盐酸和pH = ll的氨水等体积混合
B.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
C.pH = 3的硫酸和pH = ll的氨水等体积混合
D.pH = 3的醋酸和pH = ll的氨氧化钡溶液等体积混合
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ•mol-1,强酸、强碱稀溶液反应的中和热为△H=-57.3kJ•mol-1,则NH3·H2O在水溶液中电离的△H等于
A.-69.4kJ/mol
B.-45.2kJ/mol
C.+69.4kJ/mol
D.+45.2kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s);△H=akJ·mol-1
C(s)+1/2O2(g)=CO(g);△H=bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H=ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=_________kJ·mol-1
(2)工业上极少用方法I制取Cu2O是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:________________。
(3)方法II为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:写出电极反应式并说明该装置制备Cu2O的原理___________________。
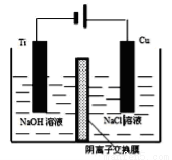
(5)在相同的密闭容器中.用以上两种方法制得的Cu2O分别进行催化分解水的实验:
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20min的平均反应速率v(O2)=7×10-5mol·L-1·min-1
C.实验②比实验①所用的Cu2O催化效率高
D.实脸①、②、③的化学平衡常数的关系:K1=K2<K3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
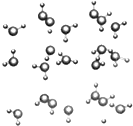 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
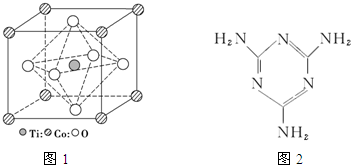 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com