
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
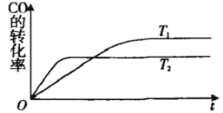
A.T1>T2,该反应的△H>0
B.加入催化剂可以提高CO的转化率
C.T1时的平衡常数时的平衡常数K1>T2时的平衡常数K2
D.温度降低,CO(g)+2H2(g)![]() CH3OH(I)的△H值将变大
CH3OH(I)的△H值将变大
【答案】C
【解析】
试题分析:A.由图可知,温度T2先到达平衡,反应速率较快,故温度T1<T2;升高温度,CO的转化率减小,说明平衡逆向移动,故正反应为放热反应,故△H<0,故A错误;B.催化剂只能改变化学反应速率,对化学平衡无影响,故B错误;C.升高温度,平衡向逆反应移动,所以T1时的平衡常数K1>T2时的平衡常数K2,故C正确;D.CH3OH(g)CH3OH(1),放出热量,故CO(g)+2H2(g)CH3OH(1)放出的热量大于CO(g)+2H2(g)CH3OH(g)放出的热量,因反应热为负值,故CO(g)+2H2(g)CH3OH(1)的△H值将变小,故D错误;故选C。


 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关分离实验操作的叙述正确的是
A.过滤操作中,玻璃棒应适时搅拌漏斗器
B.蒸发时,蒸发皿可以放置于铁架台上加热
C.萃取分液时,密度小的物质从分液漏斗的下端口放出
D.蒸馏时,温度计浸入蒸馏烧瓶的液体混合物之中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的原子核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强。其原子半径随原子序数的变化如图所示。下列说法不正确的是
A. ZX2为酸性氧化物,只能与碱溶液反应
B. 简单氢化物的热稳定性:Z<W
C. 化合物YWX中既含离子键,又含共价键
D. W的最高价氧化物对应的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,若缓缓加入稀硫酸直至过量,整个过程中混合溶液中的导电能力(用I表示)可近似地用下图中的曲线表示的是( ) 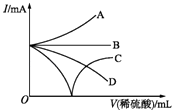
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某学生从一种强酸性的未知无色溶液中检出Ag+,他还想通过实验检验溶液中是否含有大量的NO3-、Cl-、CO32-、Cu2+、Fe3+、K+等。一定存在的离子是_______;一定不存在的离子是_______;不能确定是否存在的离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①pH=2的CH3COOH溶液;②pH=2的H2SO4溶液;③pH=12的氨水;④pH=12的NaOH溶液。室温条件下,有关上述溶液的比较中,正确的是( )
A. 水电离的c(H+):①=②=③=④
B. 将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D. 向10 mL上述四溶液中各加入90 mL水后,溶液的pH:③>④>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2FeCl3+2KI=2FeCl2+2KCl+I2,其中_____元素化合价升高,则该元素________电子,被________;_______元素化合价降低, 则该元素 _________电子,被_______;_______是氧化剂,____是还原剂,还原剂发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O
B.5molFe和4molCl2反应:5Cl2+4Fe ![]() ?2FeCl2+2FeCl3
?2FeCl2+2FeCl3
C.向Ca(ClO)2 溶液中通入过量的 SO2:C1O﹣+SO2+H2O=HClO+HSO3﹣
D.FeSO4酸性溶液中加H2O2:2Fe2++H2O2=2Fe3++2OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com