
 常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )
常温下,向20mL0.2mol?L-1H2A溶液中滴加0.2mol?L-1NaOH溶液.有关微粒的物质的量变化如图,根据图示判断,下列说法正确的是( )| A、图中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2- |
| B、当V[NaOH(aq)]=20mL时,溶液中由水电离出的c(OH-)大于10-7 mol?L-1 |
| C、当V[NaOH(aq)]=40 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| D、向NaHA溶液加入水的过程中,pH可能增大也可能减小 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
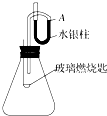 已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.
已知二硫化碳(CS2)在常温下呈液态,将其在氧气中燃烧生成二氧化碳和二氧化硫.常温下,按如图所示配好装置,待内外空气压强相等时,水银柱液面在A处.取下橡皮塞,在玻璃燃烧匙中加入二硫化碳,用酒精灯点燃,并迅速移入锥形瓶中,再塞紧橡皮塞,二硫化碳安静地燃烧,A处水银柱液面下降.查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.
A、B、C、D、E均为短周期元素,其化合价与原子序数的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、氨气:N2+3H2
| ||||
B、铝:2Al2O3(熔融)
| ||||
C、氯气:MnO2+4HCl(浓)
| ||||
D、硫酸:2SO2+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com