
| A. | 946kJ/mol | B. | 896kJ/mol | C. | 649kJ/mol | D. | 431kJ/mol |
分析 旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算.
解答 解:已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x,
对于反应N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
反应热=反应物的总键能-生成物的总键能,故△H=xkJ/mol+3×436kJ/mol-2×3×391=-92kJ/mol
解得:x≈946kJ/mol,
故选A.
点评 本题考查反应热的有关计算,掌握反应热与键能的关系是解答关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
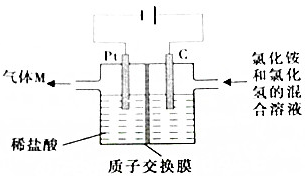 常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )
常温下,NCl3是一种黄色粘稠状液体,是制备新型水消毒剂ClO2的原料,可以采用如图所示的装置制备NCl3,下列说法正确的是( )| A. | 每生产1molNCl3,理论上有4molH+经质子交换膜有右侧向左侧迁移 | |
| B. | 可用湿润的淀粉纸质检验气体M | |
| C. | 石墨极的电极反应式为NH4++3Cl--6e-=NCl3+4H+ | |
| D. | 电解过程中,质子交换膜右侧溶液的pH会减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应在高温下才能自发进行 | |
| B. | 再加入一定量CO2,则n(CH3OH)/n(CO2)减小 | |
| C. | 温度升高,反应的平衡常数K增大 | |
| D. | 当CO2和H2转化率相等时,该反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:SiO2<CO2 | B. | 沸点:H2O<H2S | ||
| C. | 晶格能:CaCl<NaCl | D. | 热稳定性:HF<HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 0.1MPa | 0.5MPa | 1MPa | 1.5MPa |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,11.2 LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | Na2O和Na2O2混合物的物质的量为1mol,其中含有的阴离子总数为NA | |
| D. | 室温下,将9g铝片投入0.5L18.4mol•L-1的H2SO4中,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
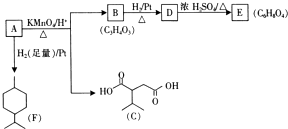
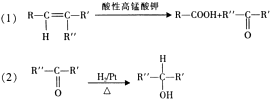
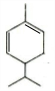 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com