
 它表示( )
它表示( )| A. | 钠离子 | B. | 氧离子 | C. | 氖原子 | D. | 氧原子 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
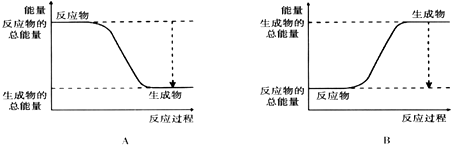
| 化学键 | H-H | O=O | H-O |
| 键能kJ.mol-1 | 436 | 496 | 463 |
| 化学键 | 填“吸收热量” 或“放出热量” | 能量变化kJ | |
拆开化学键 | 2molH2和1molO2中的化学键 | ||
| 形成化学键 | 4molH-O键 | ||
| 总能量变化 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
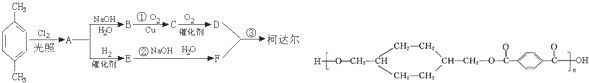
 ;D
;D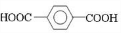 ;E
;E
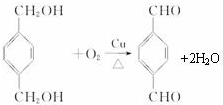 ,反应类型氧化反应
,反应类型氧化反应 ,反应类型取代反应
,反应类型取代反应 +
+ $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$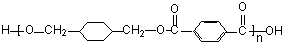 +(2n-1)H2O,反应类型缩聚反应.
+(2n-1)H2O,反应类型缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
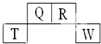 短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是( )| A. | H2R2的分子中既含有极性共价键,又含有非极性共价键 | |
| B. | T的氧化物是一种良好的半导体材料 | |
| C. | Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 | |
| D. | Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
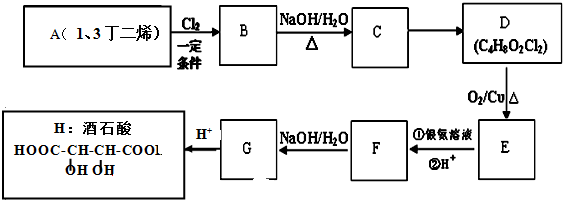

 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
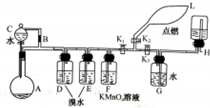 有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:
有一同学准备用Al4C3(含少量Mg2C3杂质)制取某种气种X(其装置图如图所示,夹持装置略),并进行以下实验项目:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 | |
| B. | 等质量锌粒和锌粉分别与等量1 mol/L HCl反应 | |
| C. | 等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 | |
| D. | 等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7 g羟基所含有的电子数为NA | |
| B. | 标准状况下,11.2L苯含有的氢原子数为3NA | |
| C. | 28 g乙烯和环丙烷(C3H6)的混合气体中含有的碳原子数为2NA | |
| D. | 1mol乙醇和1mol乙酸和浓硫酸共热,充分反应后生成乙酸乙酯分子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com