
分析 将0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,反应后溶质为等浓度的HA、NaA,测得混合溶液中c(Na+)>c(A-),根据物料守恒c(HA)+c(A-)=2c(Na+)可得:c(HA)>c(Na+)>c(A-),说明A-的水解程度大于HA的电离程度,溶液呈碱性,
(1)根据分析可知,c(HA)>c(Na+)>c(A-);
(2)依据溶液中物料守恒计算得到;
(3)酸抑制了水的电离,能够水解的盐溶液促进了水的电离;
(4)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA和HA,且二者的物质的量浓度相等,测得混合溶液的pH<7,说明酸的电离程度大于酸根离子的水解程度;
(5)①H2S,硫化氢在溶液中部分电离出氢离子,溶液显示酸性;②NaHS溶液中,硫氢根离子的电离程度需要水解程度,溶液显示碱性;③Na2S溶液中硫离子水解,溶液显示碱性,且硫离子水解程度大于硫氢根离子,溶液的pH大于②;④H2S和NaHS混合液,硫化氢的电离程度大于硫氢根离子的水解,溶液显示酸性,由于硫氢根离子抑制了硫化氢的电离,则溶液酸性小于①,据此判断溶液的pH.
解答 解:(1)0.2mol/L HA溶液与0.1mol/L NaOH溶液等体积混合,反应后溶质为等浓度的HA、NaA,测得混合溶液中c(Na+)>c(A-),根据物料守恒c(HA)+c(A-)=2c(Na+)可得:c(HA)>c(Na+)>c(A-),
故答案为:<;
(2)根据溶液中的物料守恒得:c(HA)+c(A-)=0.1mol/L,
故答案为:=;
(3)酸或碱抑制水电离,含有弱根离子的盐促进水电离,所以混合溶液中,由水电离出来的c(OH-)>0.2mol/L HA溶液中由水电离出的c(H+),
故答案为:>;
(4)如果取0.2mol/L HA溶液与 0.1mol/L NaOH 溶液等体积混合,则溶液中的溶质是NaA、HA,测得混合溶液的pH<7,说明HA的电离程度大于A-的水解程度,
故答案为:>;
(5)①H2S、④H2S和NaHS的溶液显示酸性,溶液中pH<7,由于④中硫氢根离子抑制了硫化氢的电离,则④中氢离子浓度小于①,则溶液的pH:①<④,
②NaHS和NaHS、③Na2S的溶液显示碱性,由于酸性硫化氢大于硫氢根离子,则③的水解程度大于②,所以溶液的pH:③>②,故四种溶液的pH从大到小的顺序为:③>②>④>①,
故答案为:③>②>④>①.
点评 本题考查了酸碱混合溶液定性判断,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握盐的水解原理、电荷守恒等知识在判断离子浓度大小中的应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 44 g由CO2和N20组成的混合气体中的氧原子数为2NA | |
| B. | 1 mol由异丁烷和正丁烷组成的混合物中含有的共价键数目为13NA | |
| C. | 2 mol SO2与2 molO2充分反应生成的SO2分子数为NA | |
| D. | 100 mL 12 mol•L-1浓盐酸与足量MnO2反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离Al2O3与Fe2O3混合物可以采取加入过量NaOH溶液充分反应后,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 将Fe(OH)3放入表面皿中,加入足量盐酸,将反应后的溶液加热蒸干、灼烧得到Fe2O3 | |
| D. | Al(OH)3中混有Mg(OH)2加入足量烧碱溶液,充分反应过滤,向滤液中加入足量盐酸后过滤、洗涤、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 土壤污染--科学灌溉,合理使用农药和化肥 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
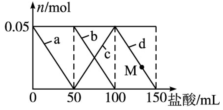 向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向100mL含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ | |
| B. | b曲线表示碳酸钠和盐酸反应,d曲线表示氢氧化铝的溶解 | |
| C. | M点时,溶液中沉淀的质量小于3.9 g | |
| D. | 原混合溶液中的Na2CO3溶液的浓度为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶粒可以导电 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子大小在1~100nm之间 | D. | 胶体的分散剂为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
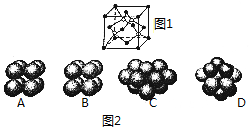 (1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同
(1)碳化硅的晶胞结构(如图1)与金刚石类似(其中“●”为碳原子,“○”为硅原子).图2中“●”点构成的堆积方式与下列图示中D所表示的堆积方式相同查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com