
| 选项 | 性质 | 用途 |
| A | 钠和钾的合金能导电 | 原子反应堆的导热剂 |
| B | 二氧化硫具有漂白性 | 漂白纸浆 |
| C | 镁燃饶时发出耀眼的强光 | 制作照明灯 |
| D | Al(OH)3加热易分解 | 塑料的阻燃剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、合金的熔点低;
B、二氧化硫具有漂白性;
C、镁条燃烧发生耀眼的强光;
D、Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低.
解答 解:A、钠和钾的合金作原子反应堆的导热剂,是因为熔点低,而不是导电,所以物质的性质和用途表述没有直接联系,故A错误;
B、二氧化硫具有漂白性,可以漂白纸浆,物质的性质和用途表述有直接联系,故B正确;
C、镁条燃烧发生耀眼的强光,可制作照明灯,物质的性质和用途表述有直接联系,故C正确;
D、Al(OH)3受热分解生成H2O并吸收大量的热量,使周围环境温度降低,且生成的氧化铝熔点较高,附着在可燃物表面,从而阻止可燃物燃烧,故D正确;
故选A.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物性质,注重基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生78g 白色沉淀 | |
| B. | 1 mol O2与金属Na充分反应,转移电子的数目为4 NA | |
| C. | 向0.1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | |
| D. | 标准状况下,用一充满干燥HCl气体的烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为$\frac{1}{22.4}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和NH3均是价电子总数为8的极性分子 | |
| B. | HS-和HCl均是含一个极性键的18电子粒子 | |
| C. | CH2Cl2和CCl4均是四面体构型的非极性分子 | |
| D. | SO2和SO3来化轨道类型均为sp2杂化,空间构型分别为V形、平面三角形 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
实验室要配制0.5 mol/L硫酸溶液500 mL,需要用10 mol/L的硫酸溶液的体积是( )
A.25 B.25 L C.25 mL D. 50 mL
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:实验题
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O2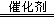 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
① 取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
序号 | 条件 | 现象 | 结论 | |
温度/℃ | 催化剂 | |||
1 | 40 | FeCl3溶液 | ||
2 | 20 | FeCl3溶液 | ||
3 | 20 | MnO2 | ||
4 | 20 | 无 | ||
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
② 实验室用MnO2做该反应的催化剂,使用如右图所示装置的A部分制备O2,避免反应过于剧烈的操作是 。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的___(填“深”或“浅”),其原因是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
B.500℃、30MPa 下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
下,将0.5molN2和1.5mol H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ·m
2NH3(g) △H=-38.6kJ·m ol-1
ol-1
C.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2 (g);△H=-283.0 kJ/mol
D.需要加热才能发生的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:填空题
Ⅰ在某一容积为5 L的密闭容器内,加入 0.2 mol的CO和0.2 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如
CO2(g)+H2(g);ΔH>0反应中CO2的浓度随时间变化情况如 下图:
下图: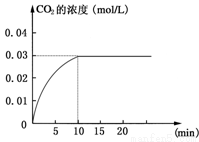
(1)根据上图数据,反应开始至达到平衡时,CO的化学反应速率为v(CO)= mol/(L·min);反应达平衡时,c(H2)=________ mol/L,该温度下的平衡常数K 。
(2) 判断该反应达到平衡的依据是________________。
① CO减少的化学反应速率和CO2减少的化学反应速率相等
② CO、H2O、CO2、H2的浓度都相等
③ CO、H2O、CO2、H2的浓度都不再发生变化
④ 正、逆反应速率都为零
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.1 mol的CO2和0.1 mol的H2,在相同的条件下,反应达平衡时,c(H2O)=_____________mol/L。
Ⅱ、在含有I-、Cl-的混合溶液中,逐滴加入一定量AgNO3溶液,当AgCl开始沉淀时,溶液中 为:___________,已知Ksp(
为:___________,已知Ksp( AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com