
 世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )
世某著名学术刊物近期介绍了一种新型中温全瓷铁--空气电池,如图所示.下列有关该电池放电时的说法正确的是( )| A. | a极发生还原反应 | |
| B. | 正极的电极反应式为FeOx+2xe-═Fe+xO2- | |
| C. | 若有22.4L(标准状况)空气参与反应,则电路中转移4mol电子 | |
| D. | 铁表面发生的反应为xH2O(g)+Fe═FeOx+xH2 |
分析 由新型中温全瓷铁--空气电池的装置图可知,a极空气中氧气得电子发生还原反应为正极,铁与水反应生成氢气,氢气在b极失电子发生氧化反应为负极,据此分析解答.
解答 解:A、a极空气中氧气得电子发生还原反应,故A正确;
B、a极空气中氧气得电子发生还原反应为正极,电极反应式为:O2+4e-═2O2-,故B错误;
C、有22.4L(标准状况)空气参与反应,则氧气为$\frac{22.4L}{22.4L/mol}$×$\frac{1}{5}$=0.2mol,则电路中转移0.8mol电子,故C错误;
D、由新型中温全瓷铁--空气电池的装置图可知,铁表面发生的反应为xH2O(g)+Fe═FeOx+xH2,故D正确.
故选AD.
点评 本题考查化学电源新型电池,题目难度中等,注意把握原电池的工作原理和电极反应的判断.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:解答题
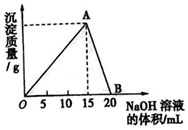 向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:
向20ml某浓度的AlCl3溶液中滴加2mol/L的NaOH溶液时,所得的沉淀质量与加入NaOH溶液的体积之间的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
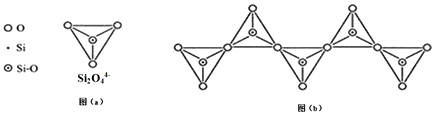
| A. | Si2O76- | B. | Si2O52- | C. | SiO32- | D. | Si4O116- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(m-x)}{m}$ | B. | $\frac{n(m-x+2)}{m}$ | C. | $\frac{m-x+2}{m-x}$ | D. | $\frac{n(m-x-2)}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
 ;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.
;Y和氢元素形成的10电子微粒中常见+1价阳离子为H3O+(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式HS-+H2O?H2S+OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
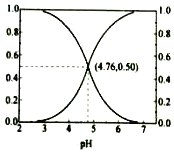 25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )
25℃时,在含CH3COOH和CH3COOˉ的溶液中,CH3COOH和CH3COOˉ二者中各自所占的物质的量分数(α)随溶液pH变化的关系如图所示.下列说法不正确的是( )| A. | 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH) | |
| B. | 在pH=7的溶液中,α(CH3COOH)=0,α(CH3COO-)=1.0 | |
| C. | 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+) | |
| D. | 在pH=4.76的溶液中加盐酸,α(CH3COOH)与α(CH3COO-)之和保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 主要现象 | 结论 |
| A | 将在酒精灯灼烧后的铜丝迅速插入无水乙醇中 | 铜丝变黑 | CH3CH2OH发生氧化反应生成CH3COOH,铜丝起催化作用 |
| B | 分别在苯和乙醇中滴加酸性高锰酸钾溶液 | 紫红色都褪去 | 苯和乙醇都有还原性 |
| C | 分别在水、乙醇中 加入钠粒 | 都产生气体 | 产生的气体为氢气 |
| D | 将酒精在空气中点燃 | 产生无色火焰 | 酒精发生氧化反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com