
| A. | CO2和SiO2 | B. | NaCl和HCl | ||
| C. | (NH4)2CO3和CO(NH2)2 (尿素) | D. | NaH和KCl |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键,不同类型的晶体的作用力不同,以此解答该题.
解答 解:A.都含有共价键,但CO2为分子晶体,SiO2为原子晶体,熔化时分别克服分子间作用力和共价键,故A错误;
B.NaCl为离子化合物,含有离子键,HCl为共价化合物,含有共价键,故B错误;
C.(NH4)2CO3为离子化合物,含有离子键,CO(NH2)2 (尿素)为共价化合物,含有共价键,故C错误;
D.NaH和KCl都为离子化合物,熔化时都克服离子键,故D正确.
故选D.
点评 本题以微粒间作用力为载体考查晶体类型,侧重考查学生对这几种晶体类型的判断能力,为高频考点,注意把握晶体类型的判断,难度不大.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题

 ,写出戊的电子式
,写出戊的电子式 ;
; NaHCO3+NaOH;(用化学反应方程式表示)
NaHCO3+NaOH;(用化学反应方程式表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸保存在玻璃试剂瓶中 | B. | 氯水保存在棕色试剂瓶中 | ||
| C. | 金属钠保存在无水酒精中 | D. | 浓硝酸保存在无色试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 反应类型为氧化反应.
反应类型为氧化反应. )的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有
)的核磁共振氢谱有1个信号峰,试写出与其互为同分异构体且核磁共振氢谱有 )为原料可以合成聚酯PTT,写出其化学方程式
)为原料可以合成聚酯PTT,写出其化学方程式 .
.
 ,请你设计出合理的反应流程图
,请你设计出合理的反应流程图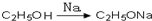 、
、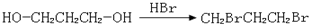 、
、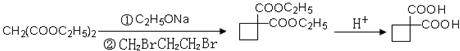 .提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …
.提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A$→_{反应条件}^{反应物}$ B$→_{反应条件}^{反应物}$ C …查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
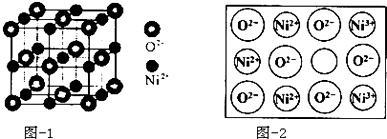
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com