
����Ŀ��ͨ�����������ĵײ�����һ��СС����֤ ���� һ�������εķ��ţ������������1~7���֣�ÿ����Ÿ�����һ�����ϲ���(������ʾ)��

(1) 2��6���������ھ�ϩ�����ʡ���ϩ�������ɹ����У��γ����µ�___(��д ��C��C��������C��H����)��������_____��Ӧ(�Ӧ����)��
(2) 1�����ϵIJ����Ǿ۶Ա��������Ҷ����������PET���ṹ��ʽ��ͼ��ʾ��

�Ƚ�1��6�����ϵĽṹ���Ʋ����ֲ��ʸ������ɿɽ������ϣ������ԭ��_______
PET�ĺϳ�·��������ʾ:

(3) �л���B�г��˱����������еĹ�������___________��
(4) ��ҵ�����У���ϩ�Ʊ��Ҷ���������ϩ������(����ͼ��ʾ)�������һ������ϩΪԭ���Ƶ��Ҷ����ĺϳɷ�����д�����ַ������漰�Ļ�ѧ����ʽ(���Լ���ѡ)��_____
(5) ͨ������;���ıȽϣ�����ҵ����ѡ����ϩ��������ԭ��(��ԭ�ϳɱ���������Ⱦ��ԭ��������3���Ƕ�����)��______
���𰸡�C��C�� �Ӿ� 1�����ϣ��۶Ա��������Ҷ������Ľṹ�к���������������̼���������ѷ���ˮ�ⷴӦ�����1�����ϸ����� ��COOH�����Ȼ����� CH2=CH2+Cl2��CH3CH2Cl��ClCH2CH2Cl+2NaOH ![]() HOCH2CH2OH+2NaCl ��ϩ�������õ�������ˮ���ɱ��ϵͣ�û�õ��������ϳ���Ҳû�д����õ�����������Һ�����������в������������������Һ����ɫ������������100%���������á���ɫ���
HOCH2CH2OH+2NaCl ��ϩ�������õ�������ˮ���ɱ��ϵͣ�û�õ��������ϳ���Ҳû�д����õ�����������Һ�����������в������������������Һ����ɫ������������100%���������á���ɫ���
��������
��1��2��6�����Ͼ�Ϊϩ�������Ӿ۷�Ӧ���ɵľ�ϩ�����ʣ�
��2���۶Ա��������Ҷ������Ĺ�����Ϊ������һ����������������ˮ�ⷴӦ�����Ҷ����ͶԱ������
��3���л���BΪ�Ա������
��4����ϩ��������Ӧ����1,2���������飬1,2����������������������Һ�й��ȷ���ˮ�ⷴӦ�����Ҷ�����
��5����ԭ�ϳɱ���������Ⱦ��ԭ��������3���Ƕȷ������ۡ�
��1��2��6�����Ͼ�Ϊϩ�������Ӿ۷�Ӧ���ɵľ�ϩ�����ʣ���Ӧ��̼̼˫�������γ���̼̼�������ʴ�Ϊ��C��C�����Ӿۣ�
��2���۶Ա��������Ҷ������Ĺ�����Ϊ������һ����������������ˮ�ⷴӦ�����Ҷ����ͶԱ������ᣬ�ױ����⣻����ϩ�����ʲ��ܷ���ˮ�ⷴӦ�����ױ����⣬�ʴ�Ϊ��1�����ϣ��۶Ա��������Ҷ������Ľṹ�к���������������̼���������ѷ���ˮ�ⷴӦ�����1�����ϸ����⣻
��3���л���BΪ�Ա������ᣬ������Ϊ�Ȼ����ʴ�Ϊ����COOH�����Ȼ�����
��4����ϩ�Ʊ��Ҷ����Ĺ���Ϊ����ϩ��������Ӧ����1,2���������飬1,2����������������������Һ�й��ȷ���ˮ�ⷴӦ�����Ҷ�������Ӧ�Ļ�ѧ����ʽΪ��CH2=CH2+Cl2��CH3CH2Cl��ClCH2CH2Cl+2NaOH ![]() HO CH2CH2OH+2NaCl���ʴ�Ϊ��CH2=CH2+Cl2��CH3CH2Cl��ClCH2CH2Cl+2NaOH
HO CH2CH2OH+2NaCl���ʴ�Ϊ��CH2=CH2+Cl2��CH3CH2Cl��ClCH2CH2Cl+2NaOH ![]() HOCH2CH2OH+2NaCl��
HOCH2CH2OH+2NaCl��
��3���ɺϳ�·�߿�֪����ԭ�ϳɱ�����ϩ�������õ�������ˮ���ɱ��ϵͣ��ӻ�����Ⱦ�Ϸ���û�õ��������ϳ���Ҳû�д����õ�����������Һ�����������в������������������Һ����ɫ��������ԭ������������ϩ������������100%���������á���ɫ��࣬�ʴ�Ϊ����ϩ�������õ�������ˮ���ɱ��ϵͣ�û�õ��������ϳ���Ҳû�д����õ�����������Һ�����������в������������������Һ����ɫ������������100%���������á���ɫ��ࡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ,����˵������ȷ����(����)


A.��Ӧ����(1)���Ȼ�ѧ����ʽΪA2(g)+B2(g)C(g)��H1=-Q1 kJ/mol
B.��Ӧ����(2)���Ȼ�ѧ����ʽΪC(g)A2(g)+B2(g)��H2=+Q2 kJ/mol
C.Q1��Q2�Ĺ�ϵ:Q1��Q2
D.��H2����H1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ں������ı�����ȷ����
A. N3������������Ϊ5 B. N3��������Ϊ21
C. Nԭ�Ӻ�����7��������ͬ�ĵ��� D. N2�ĵ���ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѹ����������ʵ��ͻ�ѧʵ��������ҪӰ�졣��ͼ����Ȫʵ���װ��ͼ��

��1���ռ�����Ӧʹ��___����Ҫ�õ�����İ���ʱ����___���������
��2��������Ӧ�ķ���ʽ���Ͱ�������ˮ���Լ��Ե�ԭ��___��
��3������ͼװ�ý�����Ȫʵ�飬�ϲ���ƿ��װ������İ���������ˮ����IJ����ǣ�___����ʵ���ԭ����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ,�������ʾ��������,�������ʾ������Һ����,���¸��鷴Ӧ���ϸ�ͼ����( )

A.CH3COOH��Һ�еμ�KOH��Һ
B.NaOH��Һ�еμ�ϡHCl
C.Ba(OH)2��Һ�еμ�ϡH2SO4
D.Cu(OH)2����Һ�еμ�HNO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȷֽⷨ�ƵõĽ����ǣ� ��
��Fe��Ag��Mg��Hg
A. �٢�B. �ڢ�C. �٢�D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п��һ������ɫ�뵼�壬Ҳ���������ѧ���ϣ��۵�1520�档
��1��п���ӵĵ����Ų�ʽ��_____________��
��2������Ԫ�������ɣ��縺��S______Se����һ������Se______As(�>����<������
��3��H2O�ķе�______________(�>����<����H2Se�ķе㣬��ԭ���ǣ�______��
��4��NaCl������ͼ��ʾ�����������Ӷ��������ͶԳƽṹ�����Ƕ����Կ�������Բ���˴ˡ����С���������Na������λ��Ϊ____������������Ϊa pm�������ӵ�������ֵ��NA��ʾ���������ܶ�Ϊ_______g��cm��3��(�г�����ʽ����

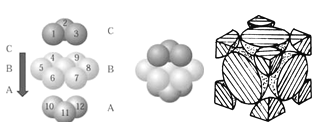
��5��ͭ������ͭԭ�ӵĶѻ���ʽ��ͼ��ʾ��ͭ������ԭ�ӵĶѻ�ģ������_______������֪ͭ��ԭ�Ӱ뾶Ϊrcm����ʾԭ�ӿռ�ռ���ʵı���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾװ�òⶨ�к��ȵ�ʵ�鲽�����£�

������Ͳ��ȡ50mL0.50mol��L-1���ᵹ��С�ձ��У���������¶ȣ�������һ��Ͳ��ȡ50mL0.55mol��L-1NaOH��Һ��������һ�¶ȼƲ�����¶ȣ��۽�NaOH��Һ����С�ձ��У��跨ʹ֮��Ͼ��ȣ���û��Һ����¶ȣ��ش��������⣺
��1��Ϊʲô����NaOH��ҺҪ�Թ���____________________��
��2������NaOH��Һ����ȷ������________(�����)��
A���ز������������� B���������������� C��һ��Ѹ�ٵ���
��3��ʹ������NaOH��Һ��Ͼ��ȵ���ȷ������________(�����)��
A�����¶ȼ�С�Ľ���
B���ҿ�ӲֽƬ�ò���������
C����������ձ�
D���������¶ȼ��ϵĻ��β������������ؽ���
��4���ֽ�һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1L1mol��L-1��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3�����H1����H2����H3�Ĵ�С��ϵΪ________��
��5��________(��ܡ����ܡ�)��Ba(OH)2��Һ�������������������Һ�����ᣬ������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�����Բ���湹�ɵ�ͼ������Բ�ڷֱ�д��C2H5OH��CO2��Fe2O3��FeCl3��NaOH�������ʣ�ͼ���������������ʾ��ɹ�Ϊһ�࣬�ཻ�IJ���A��B��C��DΪ����Ӧ�ķ�������š���ش��������⣺

��1���������ʶ������������____(����������)��д������������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ____��
��2�����������A��ʾ___(����ѡ��)��
a.�����ʶ��Ƿǵ����
b.�����ʶ����л���
c.�����ʶ��Ǻ�̼������
d.�����ʶ���������
��3���������������е�ijһ��������ij��ǿ�ᷴӦ���������е���һ�����ʣ��÷�Ӧ�Ļ�ѧ����ʽΪ____��
��4���ýྻ���ձ�ȡ25 mL����ˮ�����������ڣ����ձ�����μ����������������е�ijһ���ʵı�����Һ�����ȳʺ��ɫ���õ��ķ�ɢϵ��Ϊ___���÷�Ӧ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com