
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
分析 (1)依据热化学方程式和盖斯定律计算得到对应反应的焓变;
(2)①分析图表数据结合化学反应速率概念计算v=$\frac{△c}{△t}$,计算平衡浓度结合平衡常数概念是生成物浓度的幂次方乘积除以反应物的幂次方乘积得到;
②反应前后是气体体积不变的反应,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大,说明改变的条件是缩小体积增大浓度,或加入一氧化氮达到新平衡后个物质浓度增大;
(3)根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点.
解答 解:(1)①2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g)△H=a kJ•mol-1
②3AlCl(g)=2Al(l)+AlCl3(g)△H=b kJ•mol-1
依据盖斯定律①×3+②×6得到:6Al2O3(s)+18C(s)=12Al(l)+18CO(g)△H=(3a+6b)KJ/mol,
即Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H=(0.5a+b)KJ/mol,
故答案为:0.5a+b;
(2)①分析图表数据,0~10min内,NO的平均反应速率v(NO)=$\frac{(1-0.68)mol/L}{10min}$=0.032 mol/(L•min),
化学平衡三段式列式计算平衡浓度:
C(s)+2NO(g)?N2(g)+CO2(g);
起始量(mol/L) 1 0 0
变化量(mol/L) 0.5 0.25 0.25
平衡量(mol/L) 0.5 0.25 0.25
K=$\frac{0.25mol/L×0.25mol/L}{(0.5mol/L)^{2}}$=0.25,
故答案为:0.032 mol/(L•min);0.25;
②30min后,只改变某一条件,反应重新达到平衡,图表数据分析可知一氧化氮,氮气,二氧化碳浓度都增大;
A.通入一定量的NO,反应正向进行,达到平衡后一氧化氮、氮气、二氧化碳浓度增大,故A符合;
B.加入一定量的活性炭是固体,对平衡无影响,故B不符合;
C.加入合适的催化剂,只能改变化学反应速率,不能改变平衡,浓度不变,故C不符合;
D.适当缩小容器的体积,反应前后是气体体积不变的反应,平衡不动,但个物质浓度增大,符合要求,故D符合;
故答案为:AD;
(3)①a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,故答案为:升高温度;
②b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,故答案为:降低产物SO3浓度;
③若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为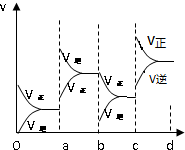 ,
,
故答案为: .
.
点评 本题考查了热化学方程式书写和盖斯定律的计算应用,侧重于化学平衡常数和反应速率概念计算应用和衡标志的分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
 工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转
工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g)$?_{加热}^{催化剂}$2SO3(g)△H<0.按照相同的物质的量投料,测得SO2在不同温度下的平衡转查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ③⑤⑥ | C. | ④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH和Na2CO3与CH3COOH和NaHCO3 | |
| B. | AgNO3和HCl与Ag2SO3和HCl | |
| C. | BaCl2和Na2SO4 与Ba(OH)2与H2SO4 | |
| D. | KOH和CH3COOH与Ba(OH)2与CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ”结构的链状化合物共有7种;
”结构的链状化合物共有7种;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | C3H8O | C. | C4H10O | D. | C5H12O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com