
氢化铝钠(NaAlH4)是最有研究应用前景的络合金属氢化物,氢化铝钠储放氢时发生反应:3NaAlH4 Na3AlH6+2Al+3H2↑。下列说法正确的是
Na3AlH6+2Al+3H2↑。下列说法正确的是
A.NaAlH4中含有离子键和非极性共价键
B.每生成11. 2 L(标准状况下)H2,转移NA个电子
C.NaAlH4中氢元素为+1价,在反应中有50%的氢被还原
D.反应中氧化产物与还原产物的物质的量之比为1:1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届安徽省铜陵市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列叙述正确的是 ( )
A.相同条件下,N2和O3的混合气体与等体积的N2所含原子数相等
B.等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等
C.常温常压下28 g CO与22.4 L O2所含分子数相等
D.16 g CH4与18 g NH所含质子数相等
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOCl2=4LiCl+S+SO2下列有关判断正确的是
A.还原剂只有锂
B.SOCl2中既有离子键,也有共价键
C.氧化产物包括LiCl和SO2
D.标准状况下生成1.12LSO2时,反应转移电子为0.1mol
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是
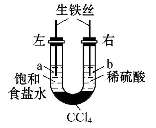
A.铁丝在两处的腐蚀速率:a < b
B.a、b两处相同的电极反应式为Fe-2e-==Fe2+
C.一段时间后,a处液面高于b处液面
D.生铁丝中的碳在a、b两处分别作原电池的负极和正极
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
下列所述事实与化学(离子)方程式不相符的是
A.能说明非金属性Cl > C: 2HCl+CaCO3==CaCl2+CO2↑+H2O
B.能说明氧化性H2O2 > Fe3+: 2Fe2++H2O2+2H+ ==2Fe3++2H2O
C.已知:H+(aq)+OH—(aq)==H2O(l) ΔH=-57.3kJ·mol-1(稀溶液),能说明稀硫酸与NaOH稀溶液反应生成1mol水,放出的热量为57.3 kJ
D.能说明CH3COOH是弱电解质: CH3COO—+H2O 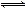 CH3COOH+OH—
CH3COOH+OH—
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:推断题
已知A为常见的金属单质,根据如图所示的转化关系回答下列问题。
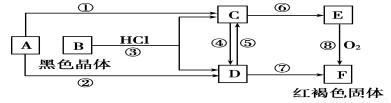
(1)确定A、B、C、D、E、F的化学式:
A为________,B为________,C为________,
D为________,E为________,F为________。
(2)写出⑧的化学方程式及④、⑤的离子方程式:
⑧
④
⑤
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是
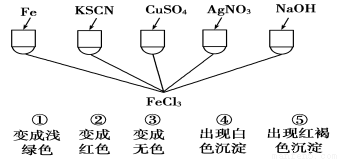
A.只有④ B.只有③ C.③和④均错 D.全部错误
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用,下列说法不正确的是
A.MgO、Al2O3可用于制作耐高温材料
B.Si可用作太阳能电池材料
C.工业上采用电解水法制氢气,解决能源短缺
D.氢氧化铝用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
以下说法正确的是()
A.某吸热反应能自发进行,因此该反应是熵增反应
B.常温下Na与足量O2反应生成Na2O随温度升高生成Na2O的速率逐渐加快
C.放热反应速率总是大于吸热反应速率
D.1gH2完全燃烧生成水蒸气时放出热量为121kJ,完全断裂1mol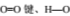 键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
键吸收热量为496kJ、463kJ,则断裂1mol H-H键时吸收热量为902kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com