
| A. | 以Al作阳极,Fe作阴极,AlCl3溶液作电解液,可以实现铁上镀铝 | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体的原理是加热促进了Fe3+水解 | |
| C. | 向纯水中加入盐酸或降温,都能使水的电离平衡逆向移动,水的离子积减小 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
分析 A.铝离子在水溶液中不易得电子;
B.加热促进了的Fe3+水解;
C.水的离子积大小和温度有关,酸碱会抑制水的电离;
D.反应的焓变与反应条件无关.
解答 解:A.在水溶液中铝离子在氢离子后放电,不能析出铝,故A错误;
B.向沸水中滴加FeCl3饱和溶液制各Fe(OH)3胶体的原因是加热促进的Fe3+水解,故B正确;
C.向纯水中加入盐酸会抑制水的电离,但是离子积不变,降温才能使水的离子积减小,故C错误;
D.焓变与反应条件无关,只与始态和终态有关,所以同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同,故D正确;
故选BD.
点评 本题考查水的电离平衡、胶体的制备、反应的焓变和电解原理的应用知识,难度不大,注意知识的迁移应用是关键,难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| B. | 在25℃、1.01×105 Pa时,11.2 L N2所含的原子数为NA | |
| C. | 18g水中所含的质子数为8NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
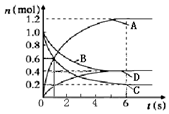 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )| A. | 该反应的化学方程式为3B+4C=6A+2D | |
| B. | 反应进行到1s时,3v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的质量分数不变 | |
| D. | 反应进行到6s时,B的平均反应速率为0.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物 质 | 选用试剂(过量) | 操作方法 | |
| A | CaO(CaCO3) | 水 | 过滤 |
| B | CuO(Fe) | 稀盐酸 | 加入稀盐酸充分反应后过滤 |
| C | CuSO4溶液(H2SO4) | 氧化铜 | 加入氧化铜粉末充分反应后过滤 |
| D | 盐酸(H2SO4) | 硝酸钡溶液 | 加入硝酸钡溶液充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、NH4+、SO42-、NO3- | B. | Na+、K+、SO42-、Cu2+ | ||
| C. | Ca2+、K+、Cl-、CO32- | D. | Mg2+、Fe3+、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
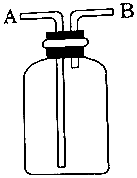
| A. | A瓶中盛满水,从B口进气,用排水法收集O2 | |
| B. | 瓶中盛适量浓硫酸,从A口进气来干燥Cl2 | |
| C. | 从B口进气,用排空气法收集Cl2 | |
| D. | 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的大约体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com