
 .
.分析 A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,则A是H元素、E是Na元素,且原子的最外层电子数的关系为A+D=B+F=8,则D为F元素,B为N、C为O、F为Al元素,
(1)B2单质为氮气,氮气分子之间N原子之间共用3对电子且每个N原子含有一个孤电子对;
由上述元素组成的分子中含有4个原子核且为18电子结构的物质H2O2;
(2)含F元素对应的金属阳离子为铝离子,铝离子和NaOH反应先生成氢氧化铝沉淀,后沉淀和NaOH反应生成可溶性的偏铝酸钠;
(3)N2H4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,反应生成Cu、氮气与水;
(4)在2L的密闭容器中,通入2mol N2气体和3mol H2气体,一定温度下反应生成NH3气体,当反应达到平衡时,H2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,则参加反应氢气为3mol-0.15mol/L×2L=2.7mol,故3mol氢气反应放出的热量为83.2kJ×$\frac{3mol}{2.7mol}$=92.4kJ;
(5)化合物NaN3与水可以反应生成两种气体单质和一种碱,应生成氮气、氢气与氢氧化钠.
解答 解:A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,则A是H元素、E是Na元素,且原子的最外层电子数的关系为A+D=B+F=8,则D为F元素,B为N、C为O、F为Al元素,
(1)N2单质的电子式: ,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为:
,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为: ;H2O2;
;H2O2;
(2)E的最高价氧化物对应水化物为NaOH,向含有Al3+离子的溶液中滴加过量NaOH的溶液,其离子方程式是:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(3)N2H4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,反应生成Cu、氮气与水,化学反应方程式是:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O,
故答案为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O;
(4)在2L的密闭容器中,通入2mol N2气体和3mol H2气体,一定温度下反应生成NH3气体,当反应达到平衡时,H2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,则参加反应氢气为3mol-0.15mol/L×2L=2.7mol,故3mol氢气反应放出的热量为83.2kJ×$\frac{3mol}{2.7mol}$=92.4kJ,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1;
(5)化合物NaN3与水可以反应生成两种气体单质和一种碱,应生成氮气、氢气与氢氧化钠,其化学方程式为:2NaN3+2H2O═3N2↑+H2↑+2NaOH,故答案为:2NaN3+2H2O═3N2↑+H2↑+2NaOH.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及化学用语、氧化还原反应、热化学方程式的书写等知识点,把握基本原理、基本性质及化学用语是解本题关键,注意常见10电子、18电子的物质.


科目:高中化学 来源: 题型:实验题
| 反应过程 | 化学方程式 | 不同温度下的K | ||
| 273.15K | 1000K | |||
| Ⅰ | 二甲醚羰基化反应 | CH3OCH3(g)+CO(g)?CH3COOCH3(g) | 1016.25 | 101.58 |
| Ⅱ | 乙酸甲酯加氢反应 | CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g) | 103.97 | 10-0.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热空气能吹出溴是利用溴易挥发的性质 | |
| B. | SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr | |
| C. | 流程中循环利用的物质有SO2、Br2、Cl2等多种 | |
| D. | 没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量的HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 自来水可以直接养金鱼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅可用于制造光导纤维 | |
| B. | 石英玻璃可用于制造光学仪器 | |
| C. | 玻璃在加热融化时有固定的熔点 | |
| D. | 制普通玻璃的原料是纯碱、石灰石、石英 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
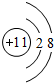 ;YW2的电子式
;YW2的电子式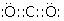 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
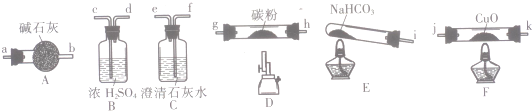
| 实验编号 | 操作 | 现象 |
| a | 加入足量稀硝酸、振荡 | 试管内红色固体完全溶解,溶液变为蓝色,并有无色气体产生 |
| b | 加入足量稀硫酸、振荡 | 试管内有红色固体,溶液为无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com