


 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:不详 题型:问答题

| 现象 | 结论 | 解释(用离子方程式表示) |
| 滴加KSCN溶液后,溶液 ______(填“变”或“不变”)红色 | ______(填“能”或“不能”)确定反应后的固体混合物中含有+3价的Fe | ①______ ②______ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.水 B.NaCl晶体 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.盐析 d.过滤 | ① | ______ | ______ |
| ②乙醇(水) | ② | ______ | ______ | ||
| ③肥皂(甘油、水) | ③ | ______ | ______ | ||
| ④硝基苯(硝酸、硫酸) | ④ | ______ | ______ | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 浓硫酸 |
| 170摄氏度 |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
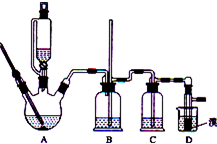
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
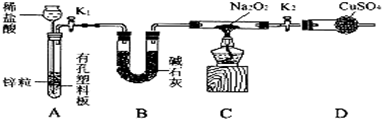
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4→HCl→K2S→NaOH→CO2 |
| B.NaCl→Na2SO4→Na2S→Na2OH→CO2 |
| C.NaCl→Na2SO4→NaS→NH3?H2O→HCl |
| D.Na2S→Na2SO4→NaCl→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
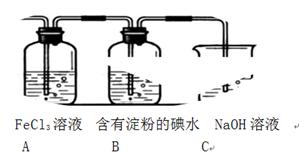
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com