
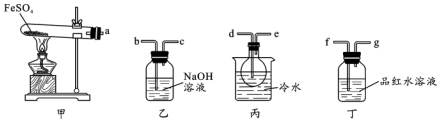
分析 I.甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用(丙装置)冰水混合物使三氧化硫液化,丁中装有品红溶液,检验二氧化硫,二氧化硫有毒,会污染空气,故用(乙装置)氢氧化钠溶液吸收.
(1)连接好装置后必须进行检查装置气密性,确保装置气密性良好,避免SO3和SO2泄漏污染空气以及影响实验的进行;
(2)甲装置为FeSO4在高温下分解装置,乙装置为吸收尾气装置,丙装置冰水混合物使三氧化硫液化,丁装置用品红溶液检验二氧化硫,据此分析选择连接口;
(3)若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2.
Ⅱ.(1)品红在碱性溶液中颜色不变,在酸性溶液中褪色,为酸和碱的中和反应,即品红显示碱性;
(2)对照实验2、3,分析可知SO32-使品红水溶液褪色;
(3)乙醇为非电解质,乙醇为有机物与品红互溶,将SO2通入品红的无水乙醇溶液,品红的无水乙醇溶液不褪色;
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽SO32-.
解答 解:I.(1)该实验装置中连接了多个仪器,且SO3和SO2是有毒气体,为避免SO3和SO2泄漏,污染空气、浪费试剂,且保证实验的顺利进行,所以在实验前需要检验装置气密性,
故答案为:检查装置气密性;
(2)甲装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即a和d相连,检验二氧化硫用品红溶液,丁中装有品红溶液,即e和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和b相连,所以按气流方向连接各仪器连接顺序为a→d→e→f→g→b→c,
故答案为:d→e→f→g→b→c;
(3)d→e→f→g→b→c(2分)
(3)若观察到装置丙中有无色液体产生为水,装置丁中溶液变成无色有二氧化硫产生,FeSO4分解生成Fe2O3、SO3和SO2,反应的方程式为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑,
故答案为:2FeSO4 $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑;
II.(1)将稀盐酸和NaOH溶液分别滴入品红水溶液中.观察到前者溶液颜色变浅,可能品红显示碱性,为酸和碱的中和反应,在酸性溶液中褪色,品红在碱性溶液中颜色不变,
故答案为:碱;
(2)实验2:二氧化硫溶于水显酸性,电离出氢离子、亚硫酸根离子、亚硫酸氢根离子,在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2,观察到前者溶液逐渐褪色,可能品红显示碱性,为酸和碱的中和反应,也可能为亚硫酸根离子、亚硫酸氢根离子使品红水溶液褪色,
后者溶液很快褪色,可能为二氧化硫和碱反应,2NaOH+SO2═Na2SO3+H2O,NaOH溶液碱性减弱,品红显示碱性,二氧化硫与之反应,溶液很快褪色,也可能为亚硫酸根离子使品红水溶液褪色.
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,为亚硫酸根离子的作用,后者溶液褪色很慢,说明不是钠离子作用,对照实验2:SO32-使品红水溶液褪色,
故答案为:SO32-;
(3)乙醇为非电解质,乙醇为有机物与品红互溶,品红的无水乙醇溶液无离子存在,将SO2通入品红的无水乙醇溶液,试预测可能出现的现象品红的无水乙醇溶液不褪色,
故答案为:品红的无水乙醇溶液不褪色;
(4)由实验2、3可推知,SO32-使品红水溶液褪色,Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽SO32-,所以加热溶有Na2SO3的品红水溶液,发现不能恢复红色,
故答案为:Na2SO3溶液中的c(SO32-)大,加热后水解程度增大,但仍无法除尽.
点评 本题考查验证分解FeSO4生成的气态产物实验、实验方案设计评价,题目难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意硫元素化合物知识的积累和灵活运用,探究SO2使品红溶液褪色的原理为该题的难点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏大 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机合成反应属于取代反应 | |
| B. | CH2=CH-COOCH3分子中处于同一平面的原子最少有3个 | |
| C. | CH2=CH-COOH没有官能团相同的同分异构体 | |
| D. | CH2=CH-COOCH3可以发生加成、氧化、取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com