
分析 0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各0.6mol,说明0.2mol烃含有0.6molC、1.2molH,则1mol有机物含有3molC、6molH,分子式为C3H6,能使溴水褪色,说明含有碳碳双键,应为烯烃,含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上,则A与HBr发生加成反应生成的物质B为CH3CHBrCH3,以此解答该题.
解答 解:①0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各0.6mol,说明0.2mol烃含有0.6molC、1.2molH,则1mol有机物含有3molC、6molH,分子式为C3H6,
故答案为:C3H6;
②能使溴水褪色,说明含有碳碳双键,应为CH2=CHCH3,故答案为:CH2=CHCH3;
③含碳碳双键的有机物与卤化氢发生加成反应时,氢原子总是加到含氢较多的双键碳原子上,则A与HBr发生加成反应生成的物质B为CH3CHBrCH3,
故答案为:CH3CHBrCH3.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握物质的结构和性质的关系,学习中注意有机物官能团的性质.


科目:高中化学 来源: 题型:选择题
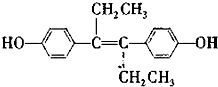 )是一种激素类药物,下列说法不正确的是( )
)是一种激素类药物,下列说法不正确的是( )| A. | 已烯雌酚分子中一定有16个碳原子共平面 | |
| B. | 已烯雌酚的分子式为C18H20O2,它为芳香族化合物 | |
| C. | 1 mol已烯雌酚可以与5 mol Br2发生反应 | |
| D. | 已烯雌酚能发生加成、取代、氧化、加聚、酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E | N | G |
| 原子半径/nm | 0.182 | 0.160 | 0.089 | 0.143 | 0.102 | 0.099 | 0.071 |
| 主要化合价 | +1 | +2 | +2 | +3 | +6、-2 | -1 | -1 |
| A. | 稳定性:HG>HN;熔沸点:HG>HN | |
| B. | 工业上常用电解熔融DN3的方法冶炼D单质 | |
| C. | B、C原子的价电子数相同 | |
| D. | 0.1mol/L的最高价氧化物的水化物溶液的pH:A≠N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
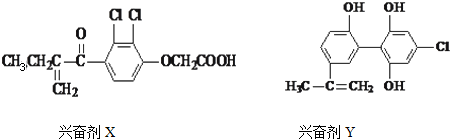
| A. | Y遇到氯化铁溶液时显紫色,Y能使溴的四氯化碳溶液褪色 | |
| B. | X的分子式为:C13H12O4Cl2 | |
| C. | 1molX与足量氢气反应,最多可消耗5molH2 | |
| D. | 1个Y分子中最多有8个碳原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解 | |
| C. | 在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解 | |
| D. | 可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 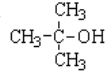 | B. | 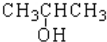 | C. | 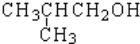 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是置换反应,HCl表现还原性 | |
| B. | 反应②是复分解反应,HCl表现氧化性 | |
| C. | 反应③中HCl既有氧化性也有还原性 | |
| D. | 反应①中氧化剂和氧化产物的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com